凝膠遷移(EMSA)是一種檢測蛋白質和DNA序列相互結合的技術,最初用於研究DNA結合蛋白和其相關的DNA結合序列相互作用,可用於定性和定量分析。這一技術 目前已用於研究RNA結合蛋白和特定的RNA序列的相互作用。
基本介紹
- 中文名:凝膠遷移
- 外文名:electrophoretic mobility shift assays,EMSA
由於很多研究的TF(轉錄因子)不具有結合的特異性,所以即使發現TF和被研究的寡核苷酸探針結合,也不表示在體內該TF不能和其它寡核苷酸結合,運用一些生物信息學 軟體,可以模擬表示TF與基因啟動子區寡核苷酸結合的具體情況,發現TF可以和啟動子區PUTATIVE 結合。
同時,由於EMSA在體外不能模 擬細胞內眾多生物分子的相互作用,比如,某一TF在細胞內由於受到其它TF的協同或者修飾後才能與寡核苷酸結合的話,那么在體外是不能重現這一結果的。
03 年上一篇關於ChIP方法的介紹文獻攻擊EMSA 沒有考慮細胞內完整自然的染色質結構和調節的影響而受到很大的限制!
涵義
引申
同時,由於EMSA在體外不能模 擬細胞內眾多生物分子的相互作用,比如,某一TF在細胞內由於受到其它TF的協同或者修飾後才能與寡核苷酸結合的話,那么在體外是不能重現這一結果的。
03 年上一篇關於ChIP方法的介紹文獻攻擊EMSA 沒有考慮細胞內完整自然的染色質結構和調節的影響而受到很大的限制!
下面是在一個PROTOCAL
1.探針的標記:
(1) 如下設定探針標記的反應體系:
待標記探針 (1.75pmol/微升) 2微升
T4 Polynucleotide Kinase Buffer (10X) 1微升
Nuclease-Free Water 5微升
[γ-32P]ATP(3,000Ci/mmol at 10mCi/ml) 1微升
T4 Polynucleotide Kinase (5-10u/微升) 1微升
總體積 10微升
按照上述反應體系依次加入各種試 劑,加入同位素後,Vortex混勻,再加入T4 Polynucleotide Kinase,混勻。
(2) 使用水浴或PCR儀,37℃反應10分鐘。
(3) 加入1微升探針標記終止液,混勻,終止探針標記反應。
(4) 再加入89微升TE,混勻。此時可以取少量探針用於檢測標記的效率。通常標記的效率在30%以上,即總放射性的30%以上標 記到了探針上。為實驗簡便起見,通常不必測定探針的標記效率。
(5) 標記好的探針最好立即使用,最長使用時間一般不宜超過3天。標記好的探針可以保存在-20℃。
2。 . 探針的純化:
通常為實驗簡便起見,可以不必純化標記好的探針。在有些時候,純化後的探針會改善EMSA的電泳結果。如需純化,可以按照如 下步驟操作:
(1) 對於100微升標記好的探針,加入1/4體積即25微升的5M醋酸銨,再加入2體積即200微升的無水乙醇,混勻。
(2) 在-70℃至-80℃沉澱1小時,或在-20℃沉澱過夜。
(3) 在4℃,12,000g-16,000g離心30分鐘。小心去除上清,切不可觸及沉。
(4) 在4℃,12,000g-16,000g離心1分鐘。小心吸去殘餘液體。微晾乾沉澱,但不宜過分乾燥。
(5) 加入100微升TE,完全溶解沉澱。標記好的探針最好立即使用,最長使用時間一般不宜超過3天。標記好的探針可以保存在 -20℃。
3。 EMSA 膠的配製:
(1) 準備好倒膠的模具。可以使用常規的灌制蛋白電泳膠的模具,或其它適當的模具。最好選擇可以灌制較薄膠的模具,以便於乾膠等後續操作。為得到更好的結果,可 以選擇可灌制較大 EMSA 膠的模具。
(2) 按照如下配方配製20毫升4%的聚丙烯醯胺凝膠(注意:使用29:1等不同比例的Acr/Bis對結果影響不大)。
TBE buffer (10X) 1毫升
重蒸水 16.2毫升
39:1 acrylamide/bisacrylamide (40%,w/v) 2毫升
80% 甘油 625微升
10% 過硫酸銨 (ammonium persulfate) 150微升
TEMED 10微升
(3) 按照上述次序加入各個溶液,加入TEMED前先混勻,加入TEMED後立即混勻,並馬上加入到制膠的模具中。避免產生氣泡, 並加上梳齒。如果發現非常容易形成氣泡,可以把一塊制膠的玻璃板進行矽烷化處理。
4。EMSA結合反應:
(1) 如下設定EMSA結合反應(預期的結果參見圖1):
陰性對照反應:
Nuclease-Free Water 7微升
EMSA/Gel- Shift結合緩衝液(5X) 2微升
細胞核蛋白或純化的轉錄因子 0微升
標記好的探針 1微升
總體積 10微升
樣品反應:
Nuclease-Free Water 5微升
EMSA/Gel-Shift結合緩衝液(5X) 2微升
細 胞核蛋白或純化的轉錄因子 2微升
標記好的探針 1微升
總體積 10微升
探針冷競爭反應:
Nuclease-Free Water 4微升
EMSA/Gel-Shift結合緩衝液(5X) 2微升
細胞核蛋白或純化的轉錄因子 2微升
未標記 的探針 1微升
標記好的探針 1微升
總體積 10微升
突變探針的冷競爭反應:
Nuclease-Free Water 4微升
EMSA/Gel-Shift結合緩衝液(5X) 2微升
細胞核蛋白或純化的轉錄因子 2微升
未標記 的突變探針 1微升
標記好的探針 1微升
總體積 10微升
Super-shift反應:
Nuclease-Free Water 4微升
EMSA/Gel-Shift結合緩衝液(5X) 2微升
細胞核蛋白或純化的轉錄因 子 2微升
目的蛋白特異抗體 1微升
標記好的探針 1微升
總體積 10微升
(2) 按照上述順序依次加入各種試劑,在加入標記好的探針前先混勻,並且室溫(20-25℃)放置10分鐘,從而消除可能發生的探針和蛋白的非特異性結合,或者 讓冷探針優先反應。然後加入標記好的探針,混勻,室溫(20-25℃)放置20分鐘。
(3) 加入1微升EMSA/Gel-Shift上樣緩衝液(無色,10X),混勻後立即上樣。注意:有些時候溴酚藍會影響蛋白和DNA的結合,建 議儘量使用無色的EMSA/Gel-Shift上樣緩衝液。如果對於使用無色上樣緩衝液在上樣時感覺到無法上樣,可以在無色上樣緩衝液裡面添加極少量的藍 色的上樣緩衝液,至能觀察到藍顏色即可。
5。 電泳分析:
(1) 用0.5XTBE作為電泳液。按照10V/厘米的電壓預電泳10分鐘。預電泳的時候如果有空餘的上樣孔,可以加入少量稀釋好的1X 的EMSA上樣緩衝液(藍色),以觀察電壓是否正常進行。
(2) 把混合了上樣緩衝液的樣品加入到上樣孔內。在多餘的某個上樣孔內加入10微升稀釋好的1X的EMSA/Gel-Shift上樣緩衝液 (藍色),用於觀察電泳進行的情況。
(3) 按照10V/厘米的電壓電泳。確保膠的溫度不超過30℃,如果溫度升高,需要適當降低電壓。電泳至EMSA/Gel-Shift上樣緩 沖液中的藍色染料溴酚藍至膠的下緣1/4處,停止電泳。
(4) 剪一片大小和EMSA膠大小相近或略大的比較厚實的濾紙。小心取下夾有EMSA膠的膠板,用吸水紙或普通草紙大致擦乾膠板邊 緣的電壓液。小心打開兩塊膠板中的上面一塊(註:通常選擇先移走矽烷化的那塊玻璃板),把濾紙從EMSA膠的一側逐漸覆蓋住整個EMSA膠,輕輕把濾紙和 膠壓緊。濾紙被膠微微浸濕後(大約不足1分鐘),輕輕揭起濾紙,這時EMSA膠會被濾紙一起揭起來。把濾紙側向下,放平,在EMSA膠的上面覆蓋一層保鮮 膜,確保保鮮膜和膠之間沒有氣泡。
(5) 乾膠儀器上乾燥EMSA膠。然後用X光片壓片檢測,或用其它適當儀器設備檢測。
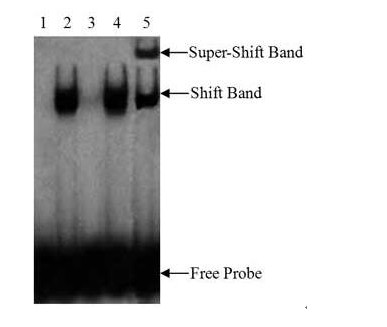
EMSA的典型分析結果可以參見下圖
說明
陰性對照反應(標記探針);2, 常規反應(含激活的目的轉錄因子的核蛋白+標記探針);3, 探針冷競爭反應(含激活的目的轉錄因子的核蛋白+標記探針+標記探針100倍量的未標記探針);4, 突變探針的冷競爭反應(含激活的目的轉錄因子的 核蛋白+標記探針+標記探針100倍量的未標記突變探針);5, Super-shift反應(含激活的目的轉錄因子的核蛋白+標記探針+目的轉錄因子的特異抗體)。
screen.width-333)this.width=screen.width-333" width=280 height=300 title="Click to view full emsa-result.jpg (280 X 300)" border=0 align=absmiddle>
生物體內DNA轉錄成RNA是基因表達的關鍵過程,基因表達調控主要發生在轉錄水平。近年來,基因分子生物學研究領域的趨勢之一是逐漸從基因結構和功能分 析轉到基因順式作用元件和轉錄因子及其轉錄調控機理上,對基因轉錄調控的研究將是今後相當長一段時期內功能基因組學研究的熱點之一。
在轉 錄水平,基因的轉錄行為是由順式作用元件(cis-acting elements)和反式作用因子(trans-acting factors)(即轉錄因子)相互作用調控的,因此要探討基因的表達調控規律,分離、鑑定基因的位點控制區(loci control region,LCR)中順式作用元件和相應轉錄因子至關重要。但僅僅如此還不夠,對於基因表達調控,必須從三個層次展開:一是分離和鑑定基因5'端核心 啟動子等順式作用元件,二是分離和鑑定與各順式作用元件相對應的轉錄因子,三是檢測各順式作用元件與對應轉錄因子的相互作用。鑑定順式調控元件和轉錄因子 是研究得比較多的內容,而對於順式作用元件與對應轉錄因子的相互作用這個層次的研究相對較為薄弱。電泳遷移率檢測(Electrophoretic Mobility Shift Assay, EMSA)是一種檢測蛋白質和DNA序列相互結合的技術,它正是對第三個層次進行研究的技術之一,核心功能是驗證蛋白質與特定核酸序列的結合特性,從而間 接推斷已知蛋白質的靶序列或已知序列的結合蛋白分子。