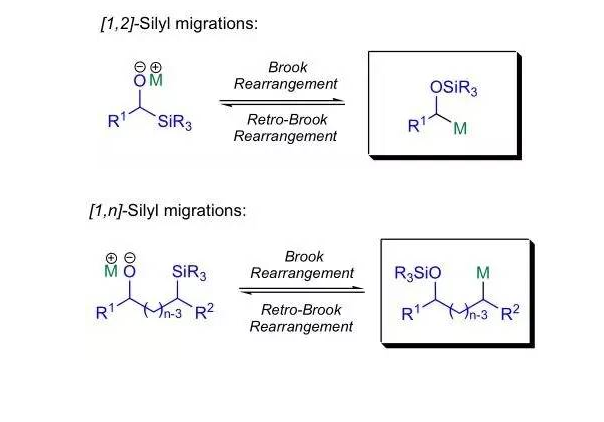
該反應是1958年加拿大的化學家Brook發現報導的。α-矽基氧負離子通過生成一個五配位矽中間體重排得到α-矽氧基碳負離子的反應稱為[1,2]-Brook重排,或[1,2]-矽基遷移。後來發現此類矽遷移反應普遍存在,因此[1,n]-矽基由碳原子遷移到氧原子的反應統稱為Brook重排。
基本介紹
- 中文名:Brook 重排
- 發現時間:1958年
- 發現人:Brook
- 機理:重排
- 領域:有機合成
反應特點,反應機理,反應實例,
反應特點
矽原子上的取代基可以是脂肪基團或芳香基團,醇可以是仲醇或叔醇,酚也可以發生此反應。常用的鹼有胺類、氫氧化鈉、有機鋰試劑或鹼金屬合金如鈉鉀合金。 Brook 重排反應的相反過程,矽基從氧到碳上的分子內遷移反應也可以發生,稱為逆-Brook重排反應。
反應機理
Brook 重排反應及逆-Brook 重排反應均經過同樣的矽負離子中間體。
反應機理中,首先是鹼奪取羥基氫,生成烷氧負離子,然後烷氧負離子作為親核試劑進攻矽原子,經過環狀的矽負離子過渡態(對於 遷移來說是三元環),負電荷轉移到碳原子上,Si-C 鍵斷裂生成碳負離子,最後碳負離子從質子供體奪取一個質子生成產物矽基醚。
由於反應中間體為有用的碳負離子,因此可發生進一步的 串聯反應。 這一策略作為高效的方法學,正在天然產物合成中獲得日漸廣泛的套用。
底物為(三苯矽基)甲基苯基原醇時,研究發現反應的活化能並不很高,但活化熵卻是十分小的負值,從而證實了反應中環狀過渡態的存在。另外,通過研究對位取代基不同的苯基原醇發生反應的哈米特方程結果,也可以證實吸電子基團對反應中碳負離子中間體的穩定作用。
Brook 重排反應的推動力是產物中鍵能較高的Si-O鍵的生成。
Brook 重排後得到構型保持的產物。下圖中的例子就利用了這個性質,使烴基取代矽烷的(+)-對映體在經過一系列反應後轉變為對應的異構體。首先它被氯氣氯化為氯矽烷,氯矽烷與二苯甲基鋰發生親核取代作用,伴隨構型翻轉。然後為了除去二苯甲基,作者首先用N-溴代丁二醯亞胺(NBS)將其溴化,接著用乙酸銀處理得到醇,然後使其在鈉鉀合金作用下發生 Brook 重排,生成二苯甲氧基取代的衍生物,並用氫化鋁鋰將 Si-O 鍵切斷,最終得到需要的烴基矽烷異構體。
[1,2]-Brook重排:
![[1,2]-Brook重排 [1,2]-Brook重排](/img/f/e29/nBnaugTNlNjYjBDOhRWM1QzYxQGMkR2MiBzMyQjZlBjYxIDZlFDZ3IzY1E2LtVGdp9yYpB3LltWahJ2Lt92YuUHZpFmYuMmczdWbp9yL6MHc0RHa.jpg) [1,2]-Brook重排
[1,2]-Brook重排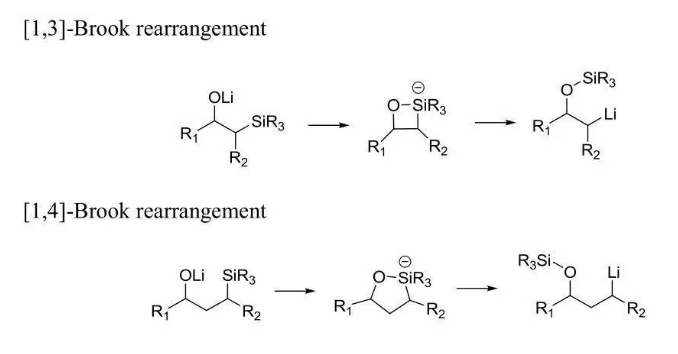 其他反應機理
其他反應機理反應實例
Brook 重排後得到構型保持的產物。下圖中的例子就利用了這個性質,使烴基取代矽烷的(+)-對映體在經過一系列反應後轉變為對應的(−)-異構體。首先它被氯氣氯化為氯矽烷,氯矽烷與二苯甲基鋰發生親核取代作用,伴隨構型翻轉。然後為了除去二苯甲基,作者首先用N-溴代丁二醯亞胺(NBS)將其溴化,接著用乙酸銀處理得到醇,然後使其在鈉鉀合金作用下發生 Brook 重排,生成二苯甲氧基取代的衍生物,並用氫化鋁鋰將 Si-O 鍵切斷,最終得到需要的(−)-烴基矽烷異構體。
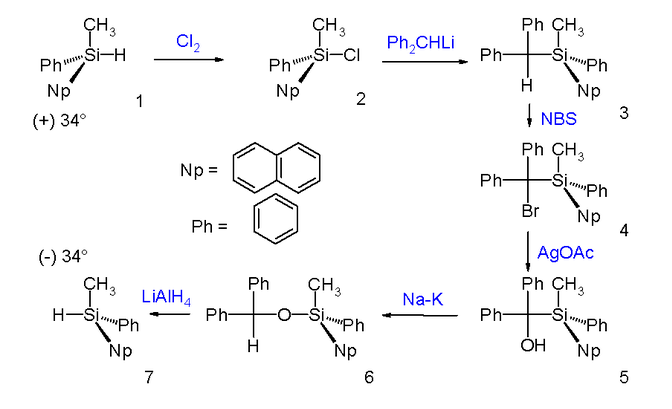 反應實例
反應實例