基本介紹
- 中文名:多元弱酸分步電離
- 舉例:H3PO4 =H++H2PO4-
- 注意:多元弱酸電離第一級為主只寫一級
- 基本步驟:電離一個氫離子再電離其他氫離子
- 相關概念:電離常數
- 常見弱酸:亞硫酸,醋酸,氫氟酸等
簡介,舉例,難易不同,注意事項,
簡介
弱酸在電離的時候,氫離子是分步電離的,即先電離一個氫離子,再電離其他的氫離子,每一步電離均有電離常數,各步的電離程度也不相同,其中第一級電離程度最大:K1>K2>K3>……>Ki。
舉例
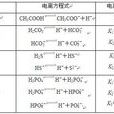
以磷酸電離為例:
H3PO4⇌H++H2PO4- K1=7.5×10-3
H2PO4-⇌H++HPO42- K2=6.2×10-8
HPO42-⇌H++PO43- K3=2.2×10-13
難易不同
例如:H2A = HA-+H+;HA-= A2-+H+前一步電離會產生氫離子,氫離子濃度增加會促使第二步電離的平衡向左移動;而且第一步電離不完全,產生的HA-的量比H2A的量要少。多元弱酸在水溶液中的電離是分步進行的。例如,二元弱酸第一步電離生成的含氫離子又發生第二步電離,這兩步電離平衡同時存在於溶液中,分別建立第一和第二步電離平衡,並對應地滿足第一和第二步電離平衡常數,常用表示。一般第二步電離遠比第一步困難,而第三步又比第二步困難。這是由於第二步電離要從已經帶有1個負電荷的離子中再分出1個正離子,當然比從中性分子中電離出1個要困難得多,同理,第三步電離就更加困難。
注意事項
1、多元弱酸電離以第一級為主,只寫第一級電離也可。
2、有氫原子不一定能電離,多元酸要能電離的氫。例如:醋酸的結構簡式是CH3COOH,那三個氫是甲基上的氫,而酸中能電離的氫一般是羥基上的,比如醋酸,CH3-COOH,就是最右邊的那個可以電離。