電荷轉移躍遷由分於的 某個部分轉移出一個電荷或其大部分電景的電子躍遷過程。 給出電荷者稱為電子給體,接受電荷者稱為電子受體、若接受電荷者為同一分子的另一部分,此過程稱為分子內電荷轉移;若發生於兩個分子之間則稱為分子間電荷轉移。典型的例子如給體一受體複合物或多色分子等。
基本介紹
- 中文名:電荷轉移躍遷
- 外文名:Charge transfer transition
- 本質:給電子體、電子受體
- 套用學科:分析化學
基本介紹
電子轉移概念
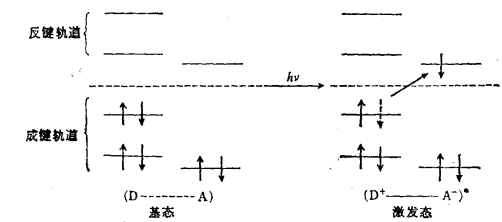 電荷轉移躍遷示意圖
電荷轉移躍遷示意圖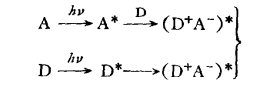 表達式
表達式溶劑的影響
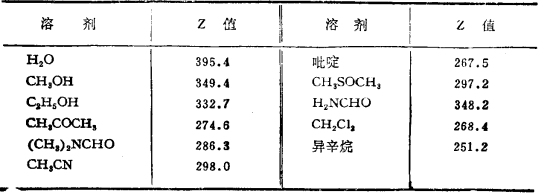 若干溶劑的Z值
若干溶劑的Z值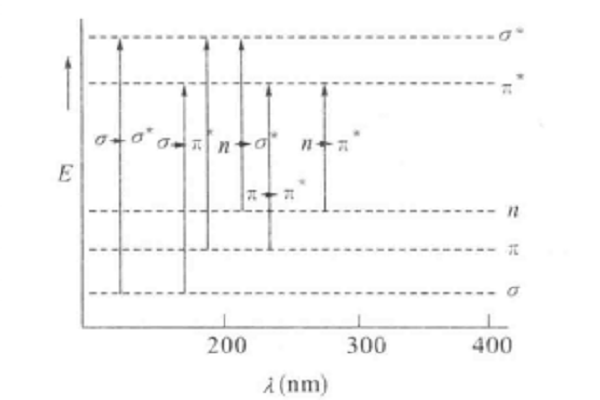
電荷轉移躍遷由分於的 某個部分轉移出一個電荷或其大部分電景的電子躍遷過程。 給出電荷者稱為電子給體,接受電荷者稱為電子受體、若接受電荷者為同一分子的另一部分,此過程稱為分子內電荷轉移;若發生於兩個分子之間則稱為分子間電荷轉移。典型的例子如給體一受體複合物或多色分子等。
 電荷轉移躍遷示意圖
電荷轉移躍遷示意圖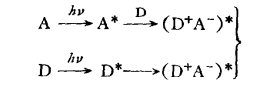 表達式
表達式 若干溶劑的Z值
若干溶劑的Z值電荷轉移躍遷由分於的 某個部分轉移出一個電荷或其大部分電景的電子躍遷過程。 給出電荷者稱為電子給體,接受電荷者稱為電子受體、若接受電荷者為同一分子的另...
電荷遷移躍遷與某些有機物相似,不少無機化合物會在電磁輻射的照射下,發生電荷轉移躍遷,產生電荷轉移吸收光譜。配合物的金屬中心離子(M)具有正電荷中心,是電子接受體...
電荷遷移光譜(charge-transfer band)是描述配合物在發生(CT)時描述吸收光強度和波長的對應關係的光譜。目錄 1 電荷遷移光譜 2 LMCT躍遷 3 MLCT躍遷 ...
電子躍遷本質上是組成物質的粒子(原子、離子或分子)中電子的一種能量變化。根據能量守恆原理,粒子的外層電子從低能級轉移到高能級的過程中會吸收能量;從高能級轉移...
在配離子中基態和激發態之間的躍遷包含著電荷遷移所產生的光譜稱為荷移光譜。電荷可以從金屬遷移到配體,也可以從配體遷移到金屬,還可以在同種金屬不同氧化態之間...
根據能量守恆原理,粒子的外層電子從低能級轉移到高能級的過程中會吸收能量;從高能級轉移到低能級則會釋放能量。能量為兩個能級能量之差的絕對值。使粒子發生躍遷的...
電荷轉移絡合物又稱電子給體-受體絡合物。指一類由富有電子和缺少電子兩種分子形成的絡合物。 例如,苦味酸(缺少電子的)和芳香烴(富有電子的)可形成具有一定熔點的...
主要內容包括:螢光光物理基礎,分子結構與發射輻射光物理過程,溶劑效應和溶劑化動力學與發射輻射光物理過程,質子轉移、溫度和黏度與發射輻射光物理過程,電荷轉移躍遷,...
UV/可見光CD被用於研究電荷轉移躍遷。近紅外CD被用於通過探測過渡金屬的d→d躍遷來研究分子的幾何和電子結構。振動圓二色性,其使用來自紅外能量區的光,被用於小有...
UV/可見光CD被用於研究電荷轉移躍遷。近紅外CD被用於通過探測過渡金屬的d→d躍遷來研究分子的幾何和電子結構。振動圓二色性,其使用來自紅外能量區的光,被用於小有...
分子激發態的能量轉移與電子轉移;分子激發態反應動力學和超快過程研究,特別側重...9.1.7 其他類型的電荷躍遷 9.2 金屬有機配合物的光取代反應機制 9.2.1 壓力對...
4. 金屬有機化合物光敏劑的合成、激發態性質研究:通過合成、鑑定、確定主要吸收在600 nm以後的金屬有機化合物光敏劑,探討電荷轉移躍遷最大吸收與中心體、配體空間...
5·7 過渡金屬絡合物的電荷轉移躍遷5·8 卟啉和酞菁衍生物參考文獻6 電化學與光譜電化學6·1 前線軌道能量及其測量6·2 有機電子給體的電化學行為及電聚合...
