氧化還原電極是一種化學反應,是通過電子遷越金屬和溶液相界面來完成反應的電極。
醌氫醌電極代表這一類。它的反應包括了氫醌一醌體系的可逆的氧化還原。鑒於它對胺基酸,蛋白質以及氧化還原反應的靈敏度,該電極作為測定pH的電極在生物研究方面的用途是有限的。在大約四十年中,醌氫醌電極被用於幾種生物液體的pH測定。
基本介紹
- 中文名:氧化還原電極
- 外文名:redox electrode
- 領域:材料化學
- 代表:醌氫醌電極
- 實質:電化學反應
- 原理:電子遷移
概述
氧化還原與原電池
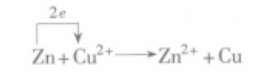 反應式
反應式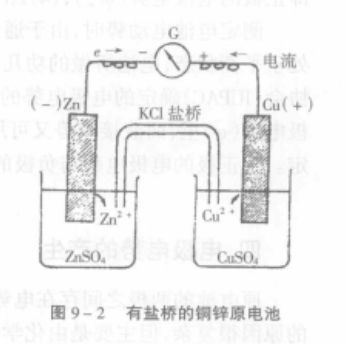 鹽橋原電池
鹽橋原電池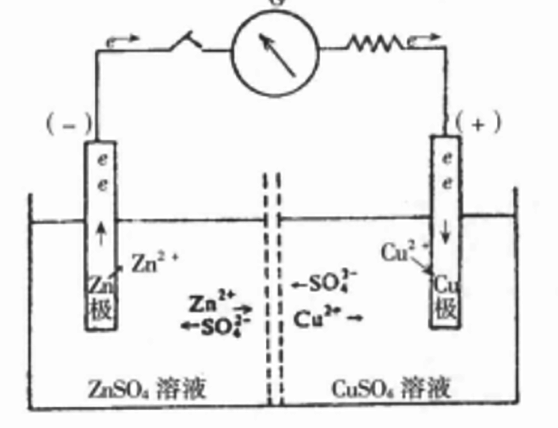
氧化還原電極是一種化學反應,是通過電子遷越金屬和溶液相界面來完成反應的電極。
醌氫醌電極代表這一類。它的反應包括了氫醌一醌體系的可逆的氧化還原。鑒於它對胺基酸,蛋白質以及氧化還原反應的靈敏度,該電極作為測定pH的電極在生物研究方面的用途是有限的。在大約四十年中,醌氫醌電極被用於幾種生物液體的pH測定。
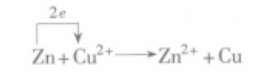 反應式
反應式 鹽橋原電池
鹽橋原電池氧化還原電極是一種化學反應,是通過電子遷越金屬和溶液相界面來完成反應的電極。醌氫醌電極代表這一類。它的反應包括了氫醌一醌體系的可逆的氧化還原。鑒於它對...
氧化還原電位就是用來反映水溶液中所有物質表現出來的巨觀氧化還原性。氧化還原電位越高,氧化性越強,氧化還原電位越低,還原性越強。電位為正表示溶液顯示出一定的...
氧化還原是一類廣泛存在的重要反應,所謂氧化還原反應是指電子從一種物質轉移到另一種物質上的化學反應。在氧化還原反應中,得到電子的物質是氧化劑,失去電子的物質是...
任何一個氧化還原反應都可以看成是兩個半反應之和:一個是氧化劑(氧化型)在反應過程中氧化數降低,氧化型轉化為還原型的半反應,另一個是還原劑(還原型)在反應...
命名方式很複雜,有些根據電極的金屬部分命名,如銅電極、鉑電極等;有些根據電極活性的氧化還原對中的特徵物質命名,如甘汞電極、氫電極;有些根據電極金屬部分的形狀...
(1)一般採用電極反應的還原電勢,每一電極的電極反應均寫成還原反應形式,即:氧化型+ne-=還原型。(2)標準電極電勢是平衡電勢,每個電對E⊖值的正負號,不隨電極...
當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位,叫做標準電極電位。 [1] 電極電位物理套用 編輯 判斷氧化還原反應自發進行的方向...
氧化還原電位計就是用來反映水溶液中所有物質表現出來的巨觀氧化-還原性設計的儀器。...
土壤氧化還原電位(soil redox potential)是指土壤氧化還原能力的度量方法,是以電位反映氧化還原狀況的指標。...
(3)在表中,物質的還原態的還原能力自下而上依次增強;物質的氧化態的氧化能力自上而下依次增強。具體地說,電對的電極電位數值越小,在表中的位置越高,物質的...
氧化-還原反應(oxidation-reduction reaction,也作redox reaction)是化學反應前後,元素的氧化數有變化的一類反應。氧化還原反應的實質是電子的得失或共用電子對的偏移。...
BRP-200A型中文線上ORP計是我公司一款全新的氧化還原電位分析儀,本表為高智慧型化線上連續監測儀,由感測器和二次表兩部分組成。...
電化學還原染色技術反應條件溫和,氧化電位可控,還原劑可再生,消耗化學品和少,廢水排放少。現已成為研究中最具可能的新型還原技術。...
氧化還原聚合是指氧化還原反應所產生的自由基引發烯類單體的聚合。20世紀30~40年代,在德國、美國、英國先後發現氧化還原聚合,當時為了縮短水溶液和乳液聚合反應的...
氧化-還原反應 (oxidation-reduction reaction, 也作redox reaction)是化學反應前後,元素的氧化數有變化的一類反應。氧化還原反應的實質是電子的得失或共用電子對的...
另外,對於電分析性能來說,因為電極上發生氧化還原反應的同時,還存在著水電解析出氧氣和氫氣的競爭反應,若被研究物質的氧化電位小於電極的析氧電位或還原電位大於電極...
因此電池反應的方向即氧化還原反應自發進行的方向。判斷氧化還原反應進行的方向時,可將反應拆為兩個半反應,求出電極電位。然後根據電位高的為正極起還原反應,電位低...
標準電極電勢表,是指半反應按電極電勢由低到高排序,可十分簡明地判斷氧化還原反應的方向。標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也就是標準態時的...
氧化還原電位,簡稱ORP (是英文Oxidation-Reduction Potential的縮寫)或Eh。ORP作為介質(包括土壤、天然水、培養基等)環境條件的一個綜合性指標,已沿用很久,它表征...
