基本介紹
- 中文名:離域鍵
- 外文名:Delocalized bonding
- 學科:化學
多個原子之間形成的共價鍵。離域鍵有缺電子多中心鍵、富電子多中心鍵、π配鍵、夾心鍵和共軛π鍵等幾種類型。當分子中總的價電子對數目少於鍵的數目時,就會...
離域是電子在分子、離子或固體金屬中不止與單一原子或單一共價鍵有作用力關係的一種電子運動狀態。一般存在於共軛系統和介離子化合物中,現代化學研究表明σ鍵中的...
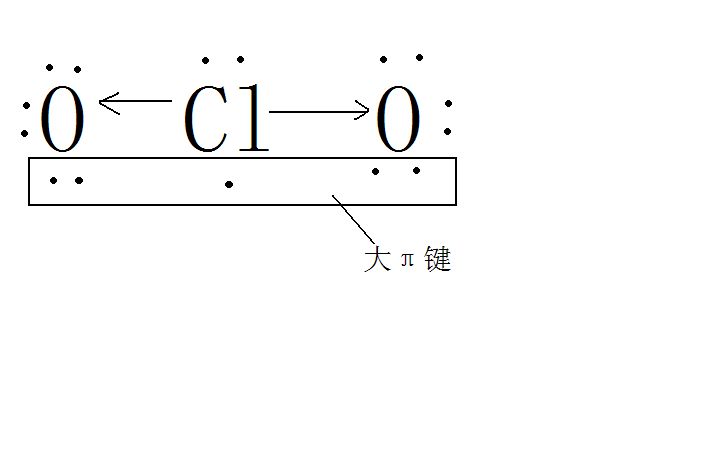
在多原子分子中如有相互平行的p軌道,它們連貫重疊在一起構成一個整體,p電子在多個原子間運動形成π型化學鍵,這種不局限在兩個原子之間的π鍵稱為離域π鍵,或...
所以金屬鍵不同於離子鍵;也不同於共享電子局限在兩個原子間的那種共價鍵(定域鍵)。廣義地說,金屬鍵屬於離域鍵,即共享電子分布在多個原子間的一種鍵,但它是...
分子分子的鍵 分子的鍵有三種極限類型,即離子鍵、共價鍵和金屬鍵。定位於2個原子之間的鍵稱為定域鍵。由多個原子的共有電子形成的多中心鍵稱為離域鍵。此外...
分子的鍵有三種極限類型,即離子鍵、共價鍵和金屬鍵。定位於2個原子之間的鍵稱為定域鍵 [1] 。由多個原子的共有電子形成的多中心鍵稱為離域鍵。此外還有過渡...
超共軛效應:當C-Hσ鍵與π鍵(或P軌道)處於共軛位置時,也會產生電子的離域現象,這種C-H鍵σ-電子的離域現象叫做超共軛效應。在超共軛體系中電子轉移的趨向...
共振論的套用主要包括說明有機化合物的物理性質和化學性質兩個方面,在物理性質方面可以用來說明分子的極性(偶極矩)鍵長,離域鍵、鍵能等,在化學性質方面可以用來...
酚羥基的氧原子採用sp2雜化,提供一對孤電子與苯環的6個碳原子共同形成離域鍵。大π鍵加強了烯醇的酸性,羥基的推電子效應又加強了O-H鍵的極性,因此苯酚中羥基的...
共振論的套用主要包括說明有機化合物的物理性質和化學性質兩個方面,在物理性質方面可以用來說明分子的極性(偶極矩)鍵長,離域鍵、鍵能等,在化學性質方面可以用來...
共振式的優點是可以利用電子式對電子離域化系統中的電荷的分配位置等進行定性的,描述套用起來很方便實用性強。[1] 共振效應基本內容 ①當一個分子或離子,按價鍵...
共振論的套用主要包括說明有機化合物的物理性質和化學性質兩個方面,在物理性質方面可以用來說明分子的極性(偶極矩)鍵長,離域鍵、鍵能等,在化學性質方面可以用來...
不飽和的化合物中,有三個或三個以上互相平行的p軌道形成大π鍵,這種體系稱為共軛體系。共軛體系中,π電子云擴展到整個體系的現象稱為電子離域或離域鍵。...
電子效應包括誘導效應(Inductive effect)和共軛效應(Conjugative effect)兩種,誘導效應是建立在定域鍵基礎上、短程的電子效應;而共軛效應是建立在離域鍵的基礎上、...
C原子上兩個未參加雜化的p軌道與sp雜化軌道成直角,並且從側面同氧原子的p軌道分別肩並肩地發生重疊,生成兩個∏三中心四電子的離域鍵。因此,縮短了碳—氧原子間...
層中每個碳原子均剩餘一個未參加sp2雜化的p軌道,其中有一個未成對的p電子,同一層中這種碳原子中的m電子形成一個m中心m電子的大∏鍵(鍵)。這些離域電子可以...
炔烴和二烯烴 離域鍵,芳烴芳核上的親電取代反應,醛和酮親核加成反應,酚和醌,羧酸和取代羧酸親核加成-消除反應,羧酸衍生物,碳負離子的反應,有機含氮化合物,...
但是,只有簡單雙鍵的化合物生色作用很有限,其有時可能仍在遠紫外區,若分子中具有單雙鍵交替的 “共軛大p鍵” (離域鍵)時,如: 丁二稀 CH2=CH—CH=CH2。...
