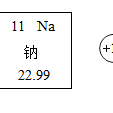
基本介紹
- 中文名:鈉
- 英文名:Sodium
- 化學式:Na
- 分子量:22.989768
- 熔點:97.81°C
- 沸點:882.9°C
- 水溶性:遇水生成NaOH,放出氫氣
- 密度:0.97克/厘米3
- 外觀:銀白色光澤
- 套用:鹼 蘇打
- 離子:Na+
鈉,原子序數11,原子量22.989768,是最常見的鹼金屬元素。 鈉單質是有銀白色光澤的軟金屬,用小刀就能很容易的切割。熔點97.81°C,沸點882.9°C,密度0.97克/...
鈉是一種金屬元素,在周期表中位於第3周期、第ⅠA族,是鹼金屬元素的代表,質地柔軟,能與水反應生成氫氧化鈉,放出氫氣,化學性質較活潑。鈉元素以鹽的形式廣泛的...
鈉-23是鈉元素其中的一種最穩定、含量最豐富的同位素。已發現鈉的同位素有15種,包括鈉19至鈉33,其中只有鈉23是穩定的,其他同位素都帶有放射性。...
《鈉鉀》是山東教育出版社出版的圖書。本書是一本綜合介紹化學元素鈉和鉀書籍,它是為幫助學習與化學元素有關的知識而精心編寫的。...
有益元素,是指在17種必需營養元素之外的雖非植物必需但對一些植物生長具有良好作用的元素。主要有矽、鈉、鈷、硒、鋁等。矽對水稻的生長發育非常重要,如果缺矽,...
《元素的世界之元素檔案》是2010年5月1日中國大百科全書出版社出版的圖書,作者是北京大學化學與分子工程學院。...
金屬鈉是在1807年利用電解氫氧化鈉製得的,這個原理套用於工業生產,約在1891年才獲得成功。1921年電解氯化鈉制鈉的工業方法實現了。由於金屬鈉在現代技術上得到重要...
鈉離子是由鈉原子失去最外層的一個電子得到的,顯正1價,書寫為Na+。鈉是一種質地軟、輕、蠟狀而極有伸展性的銀白色的IA族的鹼金屬元素。...
鈉是生命元素之一,主要存在細胞外液中,能維持體內水平衡和肌肉的興奮性。成年人每日攝入鈉宜為1100~3300毫克。飲食中大部分的鈉是以氯化鈉形式存在,是食鹽的...
焰色反應,也稱作焰色測試及焰色試驗,是某些金屬或它們的化合物在無色火焰中灼燒時使火焰呈現特殊顏色的反應。其原理是每種元素都有其個別的光譜。樣本通常是粉或...
稀有氣體是元素周期表上的0族元素。在常溫常壓下,它們都是無色無味的單原子氣體,很難進行化學反應。稀有氣體共有七種,它們是氦(He)、氖(Ne)、氬(Ar)、氪(...
而氣泡水是由氣泡水機利用瞬間的強大壓力,僅將食用級的二氧化碳氣體壓入水中,相對於產生大量鈉元素的蘇打水,氣泡水顯得更加純淨。[1] 功能 促進血液循環 碳酸...
天然蘇打水除含有碳酸氫鈉元素外,還含有多種微量元素成分,是上好的飲品。 世界上只有中、法、俄、德等少數國家出產天然蘇打水。國內的天然蘇打水水源地有四川樂山...
飲食習慣是指人們對食品和飲品的偏好。其中包括對飲食材料與烹調方法以及烹調風味及佐料的偏好。飲食習慣是飲食文化中重要元素,世界各國人們的飲食習慣由於受到地域、物...
火鹼液即氫氧化鈉,固體溶於水放熱;又稱燒鹼、火鹼、苛性鈉,是常見的、重要的鹼,英文名稱sodiun hydroxide(別名Caustic soda)。...
焰色試驗,也稱作焰色測試及焰色反應,是某些金屬或它們的化合物在無色火焰中灼燒時使火焰呈現特徵的顏色的反應。其原理是每種元素都有其個別的光譜。樣本通常是粉...
水中含有鋰、鍶、鐵、鋅、銅等十幾種於人體有益的微量元素,水質經國家地礦部、輕工部、衛生部有關專家鑑定為:超低鈉礦化度的偏矽酸重碳酸鈣鎂型天然飲用礦泉...
食鹽即是氯化鈉,氯和鈉元素都是身體內所必需的離子,多又不行,少了也不行。以鈉為例,血液中的鈉離子是維持血漿滲透壓的主要離子,多了滲透壓便上升,水份會從血...
檸檬富含維生素C、糖類、鈣、磷、鐵、維生素B1、維生素B2、煙酸、奎寧酸、檸檬酸、蘋果酸、橙皮苷、柚皮苷、香豆精、高量鉀元素和低量鈉元素等,對人體十分有益...
進行鉀元素的焰色反應時需要使用藍色的鈷玻璃,以濾去鈉元素的黃色火焰。金屬鈷鈷過量表現 編輯 經常注射鈷或暴露於過量的鈷環境中,可引起鈷中毒。兒童對鈷的毒性...
