歷史,原因,實驗,實驗用品,套用,常見類型,實驗步驟,鈉離子,鉀離子,鋰離子,鈣離子,鍶離子,鋇離子,銅離子,總結,改進裝置,簡化操作程式,改進後的優點,其他,注意事項,
歷史
焰色反應是一種非常古老的定性分析法,早在中國南北朝時期,著名的煉丹家和醫藥大師
陶弘景(456 —536) 在他的《
本草經集注》中就有這樣的記載“以火燒之,紫青煙起,雲是真硝石(硝酸鉀)也”。由於當時及以後的許多年裡,生產力水平不高,這種方法一直沒有得到廣泛的套用及發展。
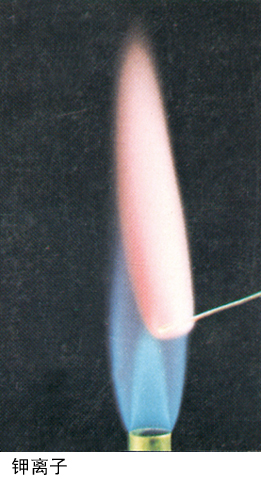 鉀鹽的焰色反應
鉀鹽的焰色反應到18 世紀以後歐洲的近代化學時期,由於冶金、機械工業的巨大發展,要求提供數量更大,品種更多的礦石;同時,也為了降低生產成本,合理使用原材料及提高產品質量,因而對分析化學提出了新的要求。德國人
馬格拉夫(1709~1782) 是這一時期的著名的定性分析化學家。他的一項重要的研究成果是觀察到了植物鹼(
草木灰,即碳酸鉀) 與礦物鹼(蘇打,即碳酸鈉) 的區別。1762 年他系統地對比了這2 種鹼轉化生成的各種
鉀鹽與鈉鹽的晶形、
潮解性和溶解度,並發現鈉鹽和鉀鹽可以分別使火焰著上各自特徵的焰色。從此以後利用焰色反應鑑別鉀、鈉鹽就成為常用手段了。後來有不少人也注意到,有很多的鹽類、氧化物在火焰中也能呈現不同的顏色,例如格梅林在1818 年發現鋰鹽呈深紅色、銅鹽呈藍綠色,但卻不明白其中的道理。而鋰鹽和鍶鹽都使火焰呈紅色,這又影響了焰色反應檢驗物質的可靠性。
19 世紀中葉,德國著名化學家本生( 1811 ~1899) 設計製造了本生燈,它使煤氣燃燒時產生幾乎無色的火焰,溫度高達一千多度。本生利用這種燈研究各種鹽類在火焰中呈現不同焰色的現象,試圖根據火焰中的彩色信號來檢測各種元素。他同時點燃3 盞煤氣燈,並分別往每個燈焰中滴加食鹽溶液。
 焰色反應
焰色反應其中一滴是飽和食鹽溶液,另一滴混有鋰鹽,第三滴混有鉀鹽。結果3 個火焰全呈黃色,看不出任何差別。顯然是鈉焰的黃色把其他的顏色掩蓋了。本生又通過藍色玻璃或靛藍溶液作濾色鏡觀察火焰,發現黃色得以濾去,滴加飽和食鹽溶液的火焰變成無色,混有鋰鹽的食鹽溶液火焰顯深紅色,混有鉀鹽的火焰呈淺紫色。後來他收集很多不同顏色的玻璃並配製許多不同顏色的溶液作為濾色材料試圖提高焰色反應的選擇性,來區別鋰鹽與鍶鹽在火中呈現的深紅色,但沒有成功。顯然憑肉眼觀察焰色來鑑別元素受到了很大的限制。我們用焰色反應也只能有限地鑑別鉀、鈉等少數幾種金屬,用藍色的鈷玻璃來觀察鉀的焰色也來源於本生的試驗。
本生除了利用煤氣火焰外,還利用煤炭火焰、氫氧焰、氫焰等。經過對焰色反應的詳細研究後,他還發現一種元素即使處於不同的化合物中,即使在火焰中發生了
化學變化,即使火焰的溫度不同,即使所使用的火焰類型不同,但這些因素對某一元素的特徵焰色都沒有影響。
後來,本生在好友物理學家
基爾霍夫的建議下,通過觀察光譜實現了對元素的定性檢驗,開創了分析化學的一個重要分支:光譜分析。
原因
焰色反應主要是根據某些金屬或者它們的揮發性化合物在無色火焰中灼燒時會呈現出不同顏色的火焰, 而對這些金屬離子進行檢驗的一種化學實驗方法, 從而可以判斷物質中是否含有這些金屬或金屬化合物。
當
鹼金屬及其鹽在火焰上灼燒時,原子中的電子吸收了能量,從能量較低的軌道
躍遷到能量較高的軌道,但處於能量較高軌道上的電子是不穩定的,很快躍遷回能量較低的軌道,這時就將多餘的能量以光的形式放出。而放出的光的波長在
可見光範圍內(波長為400nm~760nm),因而能使火焰呈現顏色。在焰色反應實驗中,,不同金屬或它們的化合物在灼燒時會放出多種不同波長的光 ,在肉眼能感知的可見光範圍內 ,因不同光的波長不同,呈現的顏色也就存在差異 。但由於鹼金屬的原子結構不同,
電子躍遷時能量的變化就不相同,就發出不同波長的光,從焰色反應的實驗裡所看到的特殊焰色就是光譜譜線的顏色.每種元素的光譜都有一些特徵譜線,發出特徵的顏色而使火焰著色,根據焰色可以判斷某種元素的存在.如焰色洋紅色含有
鍶元素,焰色藍綠色含有銅元素,焰色黃色含有鈉元素,焰色紫色含有鉀元素,磚紅色則含有鈣元素等。
實驗
實驗用品
鉑絲(或鐵絲、鎳絲)、
酒精燈(或煤氣燈、本生燈、酒精噴燈)、稀鹽酸、藍色
鈷玻璃(檢驗鉀時用)。
操作過程
①將鉑絲蘸稀鹽酸在無色火焰上灼燒至無色;②蘸取試樣(固體也可以直接蘸取)在無色火焰上灼燒觀察火焰顏色(若檢驗鉀要透過藍色鈷玻璃觀察,因為大多數情況下制鉀時需要用到鈉,因此鉀離子溶液中常含有鈉離子,而鈉的焰色反應為黃色,黃色與少量的紫色無法分別出來).③將鉑絲再蘸稀鹽酸灼燒至無色,就可以繼續做新的實驗了。
若在焰色反應時,看到的火焰為黃色,那是玻璃中的鈉燃燒的顏色掩蓋了金屬燃燒的顏色。
套用
(1)利用焰色反應可檢驗某些用常規化學方法不能鑑定的金屬元素。
(2)不同的金屬及其化合物對應不同的焰色反應且顏色艷麗多彩,因此可用於製作節日燃放的煙花等。
常見類型
常見焰色反應:
元素符號
| 元素名稱
| 焰色
|
|---|
Ba
| | 黃綠
|
Ca
| | 磚紅
|
Cs
| | 紫紅 |
Cu(I)
| | 淺藍
|
Cu(II)
| 銅(II) (沒鹵素)
| 祖母綠
|
Cu(II)
| 銅(II) (有鹵素)
| 藍綠
|
Fe(III)
| | 無色
|
In
| | 藍
|
K
| | 淺紫
|
Li
| | 紫紅
|
Mn(II)
| | 黃綠
|
Mo
| | 黃綠
|
Na
| | 黃
|
Pb
| | 綠
|
Rb
| | 紫
|
Sb
| | 淺綠
|
Sr
| | 洋紅
|
Tl
| | 綠
|
Zn
| | 藍綠
|
實驗步驟
鈉離子
鈉的焰色測試
先準備一支鉑或鎳鉻絲、鐵絲,鈷藍玻璃及鹽或其溶液。
把線圈浸在濃氫氯酸中以清除先前餘下的物質,再把線放在無光焰(藍色火焰)中直至沒有顏色的變化。
用蒸餾水或去離子水或純水沖洗線。
用線圈接觸鹽或溶液,通過無光焰(藍色火焰)中加熱。
當鈉離子存在於所測試的溶液中,用鈷藍玻璃過濾鈉離子的焰色。
最後將觀察焰色。鈉的焰色為明亮的金黃色火焰。
鈉的焰色反應本應不難做,但實際做起來最麻煩。因為鈉的焰色為黃色,而酒精燈的火焰因燈頭燈芯不乾淨、酒精不純而使火焰大多呈黃色。即使是近乎無色(淺淡藍色)的火焰,一根新的鐵絲(或鎳絲、鉑絲)放在外焰上灼燒,開始時火焰也是黃色的,很難說明焰色是鈉離子的還是原來酒精燈的焰色。要明顯看到鈉的黃色火焰,可用如下方法。⑴方法一(鑷子-棉花-酒精法):用鑷子取一小團棉花(脫脂棉,下同)吸少許酒精(95%乙醇,下同),把棉花上的酒精擠乾,用該棉花沾一些氯化鈉或無水碳酸鈉粉末(研細),點燃。
⑵方法二(鐵絲法):①取一條細鐵絲,一端用砂紙擦淨,再在酒精燈外焰上灼燒至無黃色火焰,②用該端鐵絲沾一下水,再沾一些氯化鈉或無水碳酸鈉粉末,③點燃一盞新的酒精燈(燈頭燈芯乾淨、酒精純),④把沾有鈉鹽粉末的鐵絲放在外焰尖上灼燒,這時外焰尖上有一個小的黃色火焰,那就是鈉焰。以上做法教師演示實驗較易做到,但學生實驗因大多數酒精燈都不乾淨而很難看到焰尖,可改為以下做法:沾有鈉鹽的鐵絲放在外焰中任一有藍色火焰的部位灼燒,黃色火焰覆蓋藍色火焰,就可認為黃色火焰就是鈉焰。
鉀離子
⑴方法一(燒杯-酒精法):
取一小藥匙無水碳酸鉀粉末(充分研細)放在一倒置的小燒杯上,滴加5~6滴酒精,點燃,可看到明顯的淺紫色火焰,如果隔一鈷玻璃片觀察,則更明顯看到紫色火焰。
 焰色反應
焰色反應(2)方法二(金屬絲法):
同鈉的方法二中的學生實驗方法。該法效果不如方法一、二、三,但接近課本的做法。
觀察鉀的焰色時,室內光線不要太強,否則淺紫色的鉀焰不明顯,如果要避免鈉鹽對觀察鉀鹽造成的影響,應通過藍色鈷玻璃觀察焰色。
鋰離子
⑴方法一(鑷子-棉花-酒精法):
 焰色反應
焰色反應用鑷子取一團棉花,吸飽酒精,又把酒精擠乾,把棉花沾滿Li2CO3粉末,點燃。
⑵方法二(金屬絲法):跟鈉的方法二相同。
鈣離子
⑴方法一(鑷子-棉花-酒精法):
同鉀的方法一。
⑵方法二(燒杯-酒精法):
取一藥匙研細的無水氯化鈣粉末(要吸少量水,如果的確一點水也沒有,則讓其在空氣吸一會兒潮)放在倒置的小燒杯上,滴加7~8滴酒精,點燃。⑶方法三(藥匙法):用不鏽鋼藥匙盛少許無水氯化鈣(同上)放在酒精燈外焰上灼燒。
鍶離子
同碳酸鋰的方法。
鋇離子
⑴方法一(鐵絲-棉花-水法):
取少量研細的氯化鋇粉末放在一小蒸發皿內,加入一兩滴水調成糊狀,取一根小鐵絲,一端用砂紙擦淨,彎一個小圈,圈內夾一小團棉花,棉花吸飽水後又擠乾,把這團棉花沾滿上述糊狀氯化鋇,放在酒精燈火焰下部的外焰上灼烤,可看到明顯的黃綠色鋇焰。
⑵方法二(棉花-水-燒杯法):
跟方法一類似,把一小團棉花沾水後擠乾,沾滿糊狀氯化鋇,放在一倒置的燒杯上,滴加七八滴酒精,點燃。可與棉花+酒精燃燒比較。
銅離子
⑴方法一(金屬絲-棉花-水法):同鋇離子的方法一相同。
 焰色反應
焰色反應⑵方法二(鑷子-棉花-酒精法):同鈉離子方法。
⑶方法三(燒杯-酒精法):同鉀離子的方法一。
⑷方法四(藥匙法):同鈣離子的方法三。
總結
焰色反應現象要明顯,火焰焰色要象彗星尾巴才看得清楚,有的鹽的焰色反應之所以鹽要加少量水溶解,是為了灼燒時離子隨著水分的蒸發而揮發成彗星尾巴狀,現象明顯;而有的離子灼燒時較易揮發成彗星尾巴狀,就不用加水溶解了。
改進裝置
擋風夾可以防止焰色干擾
對於常用型號的
酒精燈,取一塊14×7.5cm
2大小的薄鐵片,按2.5cm折兩次,變成長和寬各為2.5cm,高為14cm的擋風夾。將其下端稍彎曲,用時夾在酒精燈上,如右圖。 再取幾根無銹鐵絲分別固定在玻璃棒上,貼上標記。每根鐵絲專用於蘸取一種樣品。以此代替鉑絲(由於條件限制,許多學校沒有那么多的鉑絲,分組實驗時更是如此)。
簡化操作程式
課堂演示實驗時,將酒精燈上擋風夾空缺的一面朝向學生。用專用鐵絲蘸取相應
樣品。可以不“先灼燒……每次用完後都要用稀鹽酸洗淨……”而直接置於外焰部位灼燒。演示鉀的焰色反應時,可先用鐵絲蘸取少量合成膠水,再“粘上”少量
氯酸鉀固體直接
灼燒,把鈷玻片置於擋風夾空缺部位進行觀察,待鐵絲稍冷後可重複進行實驗。對於其它易受外界條件干擾,焰色展示不明顯的也可採用此法。實驗結束後,取下擋風夾,熄滅酒精燈。
改進後的優點
通過增設擋風夾既能避免實驗時酒精燈火焰受風乾擾,能有效地提升火焰的長度,又不會擋住學生視線,還可以形成背景底色,有利於對比觀察;改用專用鐵絲蘸取樣品解決了缺少鉑絲之苦,還能簡化操作。而用合成膠水“粘”取固體樣品灼燒,不但不會影響觀察焰色,還能有效防止樣品飛濺,延長焰色時間,簡單實用。
 焰色反應
焰色反應其他
鹼金屬和其它一些金屬及其相應離子所發生的焰色反應可用於分析物質的組成,進行有關物質的鑑別.如:鈉或含有Na+的化合物焰色反應為黃色;鉀或含K+的化合物焰色反應為淺紫色(透過鈷玻璃).
鎂、鋁,還有鐵、鉑、鎳等金屬無焰色。
焰色反應中釋放出的各種可見光實質上是由於熱源的溫度很高,做焰色反應的金屬離子受熱後能量升高,激發電子躍遷,能級間的能量差以可見光的形式釋放出來,這個過程沒有新的物質生成,只是電子的躍遷,應該屬於物理變化。所以,雖然稱作 焰色反應 ,實際上並不是 化學變化 ,而是 物理變化 。
焰色反應在使用中只能用鹽酸來洗鉑絲
原因:生成金屬氯化物,而一般金屬氯化物在高溫時易揮發。
注意事項
實驗過程中,對於未知液體,利用焰色反應檢驗離子,因為溶液中可能會含有其他有毒物質,加熱後可能會揮發出來,或者加熱時可能生成有毒物質,會可能會對實驗人員造成傷害。
 鉀鹽的焰色反應
鉀鹽的焰色反應 焰色反應
焰色反應 焰色反應
焰色反應 焰色反應
焰色反應 焰色反應
焰色反應 焰色反應
焰色反應
