簡介
酵母質粒載體是基因表達載體的一種,既可以在大腸桿菌中、又可以在酵母系統中進行複製與擴增,所以也稱為
穿梭載體。它分為整合載體和自我複製載體兩類。①整合載體:它帶有一個酵母URA3標誌基因和大腸桿菌的複製和報告基因。由於質粒DNA與酵母基因組DNA之間發生了同源重組,在轉化的細胞中可以檢測到質粒的整合複製。整合載體中的YIp載體(yeast integrating plasmid)的轉化效率低,而且不穩定;②自我複製載體:該類載體在酵母中可以自我複製,主要有YRp(yeast replication plasmid)、YEp(yeast extrachromosomal plasmid)和YCp(yeast centromere plasmid)。YRp在遺傳學方面極不穩定;YEp可以很快與酵母內源質粒重組,重組後YEp載體很快複製並擴增。YCp質粒的遺傳特性是拷貝數少且遺傳性穩定;③釀酒酵母載體系統:
釀酒酵母在基因工程技術操作中,作為克隆宿主或作為調節表達序列(如RNA聚合酶識別位點及核糖體識別位點)的
克隆載體,其套用廣泛。在酵母細胞核中某些自我複製型質粒(如大腸桿菌質粒)也能獲得高拷貝。如在酵母中最大限度的表達基因,需要特異的啟動子,如乙醇脫氫酶、同工酶一1、磷酸甘油激酶、酸性磷酸酶和α因子等基因的啟動子等。通過
DNA重組技術,還可以利用釀酒酵母生產外源蛋白。B型肝炎疫苗就是利用酵母為宿主得到的第一種醫用蛋白,另外組織型血纖維蛋白溶源激活因子、胰島素和水蛭素等蛋白質產品也是利用酵母為宿主細胞生產的。
在實驗方案設計中由於釀酒酵母不能對真核內含子進行識別和處理,因而外源基因須使用cDNA,產物蛋白是在胞內表達還是向外分泌也是十分重要的,因為這關係到基因工程下游工程的工藝設計。採用釀酒酵母表達系統還要注意選擇適當的啟動子和終止子;考查表達盒的穩定性;針對外源蛋白質積累部位的不同,採取相應的處理步驟;還要注意提高產量。
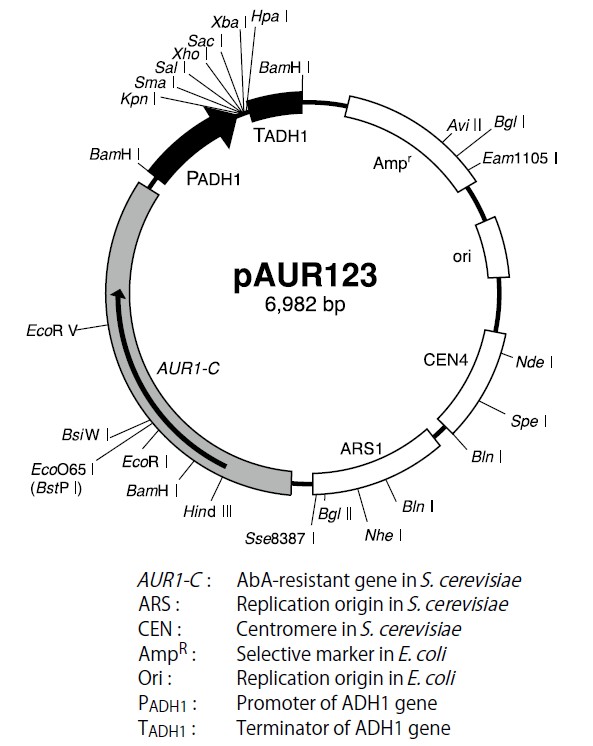
酵母質粒載體的特點
酵母質粒載體既可以在大腸桿菌複製與擴增、又可以在酵母系統中複製與擴增,故此類載體又稱為穿梭載體(shuttlevector)。
在基因工程中,套用上述病毒表達載體在哺乳動物細胞中進行中、小規模的表達是十分實際的。還要有對組織培養技術十分熟悉的前提。但病毒載體的運用仍然存在技術較難、耗時間和不經濟的問題.難以大規模地進行表達。介於細菌質粒和動物病毒載體之聞的酵母質粒載體,從技術和經濟角度而占,可能更適合當前國內大多數研究室的需要。
根據轉化細胞中的複製機制,可將酵母質粒載體分為兩個基本類型即整合載體和自我複製載體。選擇酵母載體的必須慎重考慮以下幾個標準:①大腸桿菌和酵母均有適當的遺傳標誌;②結合實際需要,考慮在酵母中的複製方式;③在酵母和大腸桿菌中的拷貝數;④要有簡單易行的篩選插入物的方式。
載體技術
基因表達載體的構建(即目的基因與運載體結合)是實施基因工程的第二步,也是基因工程的核心。
將目的基因與運載體結合的過程,實際上是不同來源的DNA重新組合的過程。所謂載體,即連線目的基因、能獨立於細胞染色體之外複製的DNA片段。目前,人們在基因工程中通常選用的載體有細菌質粒載體、λ噬菌體載體、柯斯質粒載體和病毒載體等。
一個理想的基因載體應該具有以下幾個基本條件:①能在宿主細胞進行獨立和穩定的DNA自我複製,並在其DNA中插入外源基因後,仍然保持著穩定的複製狀態和遺傳特性;②易於從宿主細胞中分離,並進行純化;③在其DNA序列中,具有適當的限制性內切酶位點(最好是單一酶切位點)。這些位點位於DNA複製的非必需區內,可以在這些位點上插入外源DNA,但不影響載體自身DNA的複製;④具有能夠觀察的表型特徵,在插入外源DNA後,這些特徵可以作為重組DNA的選擇標誌。
上述基本條件主要是從原核生物DNA重組中得出的。到了真核生物階段,由於將外源DNA引入宿主的方法有了改進,突破了原有要求重組DNA片段的大小限制.因此使得外源DNA進入宿主的能力增強了;同時.由於篩選重組體技術的改進,原來要求載體或外源DNA上有選擇標記已經被雜交技術、免疫學技術等替換,從而擴大了DNA重組技術使用的範圍。所以,作為載體的最基本要求有了改變,即要有自主複製能力和可利用的限制酶切點。
質粒是小型環狀DNA分子,大小為1~200kb(1kb=1000鹼基對)。質粒不同於病毒,是裸露的DNA分子,沒有外殼蛋白,在基因組中,也沒有溶菌酶基因。質粒在宿主細胞內才能完成自身複製,同時將編碼的一些非染色體控制的遺傳性狀進行表達,賦予宿主細胞一些額外的特性,包括抗性特性、代謝特性等,其中對抗生素的抗性是質粒最重要的編碼特性之一。
質粒載體絕大多數是以天然質粒為基礎,加以人工改造和組建。理想的細菌質粒載體,除去其他類型載體相同的特點外,還應具備以下條件:①相對分子質量儘可能小,質粒越小,拷貝數越高,而且便於提取和純化;②DNA結構和功能清楚,質粒序列中具有包含一系列單一限制酶酶切位點的多克隆位點,便於帶有不同末端的外源片段的插入;③具有在宿主中合適的一個或多個選擇標記,用以篩選攜帶有目的片段的克隆,這類選擇標記可以分為顯性標記和營養缺陷型標記,最主要的顯性標記是各種抗生素抗性基因(如氨苄青黴素抗性基因、四環素抗性基因、阿泊拉黴素抗性基因、氯黴素抗性基因等);④缺失流動基因,這樣質粒就不會從一個細菌接觸轉移到另一個細菌。
在基因工程中,有些載體可用於外源基因的表達等特殊用途,但一般的克隆實驗可按載體的不同性質,區分為數種不同的類型。若DNA重組中克隆是要獲得大量的高純度的DNA片段,則可選用具有高拷貝數的質粒載體,如ColE1等鬆弛型複製子質粒;有些外源基因用高拷貝數質粒載體克隆後。其產物含量過高,會干擾寄主細胞的新陳代謝活動,對於這樣的克隆基因,則最好選用由嚴緊型複製子PSC101派生而來的質粒載體,如PLG338、PLG339等,這些質粒的拷貝數在每個細胞只有幾個,可在低水平的基因劑量下增殖克隆的外源DNA片段。
質粒克隆載體的設計和構建過程應遵循以下幾條原則。
①選擇合適的出發質粒
出發質粒也叫親本質粒,它應含有質粒克隆載體必備的元件,如複製起始位點、選擇標記基因、克隆位點、啟動子和終止子等。
②正確獲得構建質粒克隆載體的元件
一般採用限制性核酸內切酶切割出質粒DNA分子,獲得含有某種元件的DNA片段,還可以採用PCR技術從靶DNA中擴增出含某種元件的特異性DNA片段。
③組裝合適的選擇標記基因
構建的質粒克隆載體應該組裝什麼樣的選擇標記基因,必須根據要轉化的受體細胞的特性來決定。
④選擇合適的啟動子
為了構建表達質粒的克隆載體,必須組裝合適的啟動子,當設計真核生物的基因須在原核生物中表達式,常改用原核生物或病毒(噬菌體)基因的啟動子,而原核生物基因在真核細胞中表達時,仍可用原核生物基因的啟動子。
由於質粒載體可用於簡便、快速、大量地製備某些克隆的DNA片段,多年來被廣泛採用並改進,產生了更多更有用的質粒載體,如PBR322、PUC系列、PSP系列、BluescriptM等。這些載體多已商品化。可以直接購買。
(2)病毒和噬菌體載體
病毒主要有DNA(或RNA)和外殼蛋白組成,經包裝後成為病毒顆粒。通過感染,病毒顆粒進入宿主細胞,利用宿主細胞的合成系統進行DNA(或RNA)複製和殼蛋白的合成,實現病毒顆粒的增殖。把感染細菌的病毒專門稱為噬菌體,由此構建的克隆載體則稱為噬菌體克隆載體。
噬菌體作為載體,可插入長10~20kb甚至更大的一些外源DNA片段,又由於噬菌體有較高的增殖能力,有利於目的基因的擴增,從而成為當前基因工程研究的重要載體之一。
野生型的噬菌體必須經過改造,才能成為比較理想的基因工程載體。噬菌體中首先被改造成為載體的是λ噬菌體,此外還有單鏈噬菌體載體、黏性質粒載體等。λ噬菌體由頭和尾構成,其基因組是長約49kb的線性雙鏈DNA分子,組裝在頭部蛋白質外殼內部,其序列已被全部測出。λ噬菌體感染時,通過尾管將基因組DNA注入大腸桿菌,而將其蛋白質外殼留在菌外。DNA進入大腸桿菌後以其兩端12bp的互補單鏈黏末端環化成環狀雙鏈,可以兩種不同的方式繁殖:溶菌性方式(lytic pathway)和溶源性方式(lysogenic pathway)。λ噬菌體含有線性雙鏈DNA分子,其長度為48502bp。兩段各有由12個核苷酸組成的5’端凸出的互補黏性末端,當λDNA進入宿主細胞後,互補黏性末端連線成環狀DNA分子,連線處稱為cos位點。
構建λ噬菌體載體的基本途徑如下:①抹去某種限制性內切酶在λDNA分子上的一些識別序列,只在非必需區保留1~2個識別序列;②用合適的限制性內切酶切去部分非必需區,但是由此構建的λDNA載體不應小於38kb;③在λDNA分子的合適區域插入可供選擇的標記基因。值得指出的是,沒有適用於克隆所有DNA片段的萬能λ噬菌體載體,必須根據據需要選擇合適的噬菌體載體。
(3)人工染色體克隆載體
人工染色體克隆載體實際上是一種穿梭克隆載體,含有質粒克隆載體所必備的第一受體(大腸桿菌)源質粒複製起始位點,還含有第二受體(如酵母菌)染色體DNA著絲點、端粒和複製起始位點的序列,以及合適的選擇標記基因。這樣的克隆載體在第一受體細胞內可以按質粒複製形式進行高拷貝複製,在體外與目的DNA片段重組後,轉化第二受體細胞。
可在轉化的細胞內按染色體DNA複製的形式進行複製和傳遞,篩選第一受體的克隆子,一般採用抗菌素抗性選擇標記;而篩選第二受體的克隆子,常用與受體互補的營養缺陷型。與其他克隆載體相比,人工染色體克隆載體的特點是能容納長達1000kb甚至3000kb的外源DNA片段。
常見的人工染色體克隆載體主要有酵母人工染色體、細菌人工染色體載體和P1人工染色體載體等。
酵母人工染色載體(YAC)是利用釀酒酵母的染色體的複製元件構建的載體,其工作環境也是在釀酒酵母中。釀酒酵母的形態為扁圓形和卵形,生長的代時為90min。YAC載體的複製元件是其核心組成成分,其在酵母中複製的必需元件包括複製起點序列即自主複製序列、用於有絲分裂和減數分裂功能的著絲粒和兩個端粒(TEL)。YAC載體的選擇標記主要採用營養缺陷型基因,如色氨酸、亮氨酸和組氨酸合成缺陷型基因trpl、leu2澀和his3、尿嘧啶合成缺陷型基因ura3以及赭石突變抑制基因sup4等。與YAC載體配套工作的宿主酵母菌(如AB1380)的胸腺嘧啶合成基因帶有一個赭石突變ade2一1。帶有這個突變的酵母菌在基本培養基上形成紅色菌落,當帶有赭石突變抑制基因sup4的載體存在於細胞中時,可抑制ade2一1基因的突變效應,形成正常的白色菌落。
利用這一菌落顏色轉變的現象,可用於篩選載體中含有外源DNA片段插入的重組子。
細菌人工染色體載體(BAC)是基於大腸桿菌的F質粒構建的,高通量低拷貝的質粒載體。每個環狀DNA分子中攜帶一個抗生素抗性標記,一個來源於大腸桿菌F因子(致育因子)的嚴謹型控制的複製子oriS,一個易於DNA複製的由ATP驅動的解旋酶。BAC載體的低拷貝性可以避免嵌合體的產生,減小外源基因的表達產物對宿主細胞的毒副作用。新型的BAC載體可以通過α互補的原理篩選含有插入片段的重組子,並設計了用於回收克隆DNA的Not工酶切位點和用於克隆DNA測序的Sp6啟動子、T7啟動子。Not Ⅰ識別序列,位點十分稀少。重組子通過Not Ⅰ消化後,可以得到完整的插入片段。Sp6、T7是來源於噬菌體的啟動子,用於插入片段末端測序。
P1人工染色體載體(PAC)結合了P1載體和BAC載體的最佳特性,包括陽性選擇標記sacB及噬菌體P1的質粒複製子和裂解性複製子。然而除了將連線產物包裝進λ噬菌體顆粒以及在cre—loxP位點使用位點特異性重組產生質粒分子以外,在載體連線過程中產生的環狀重組PAC也可能用電穿孔的方法導入大腸桿菌中,並且以單拷貝質粒狀態維持。基於PAC的人類基因組文庫插入片段的大小在60~150kb之間。