基本介紹
- 中文名:三氧化二氫
- 別稱:過三氧化氫
- 化學式:H2O3或HOOOH
- 分子量:50
- 外觀:常溫下為無色至微紫色液體
- 氣味:有魚腥味
- 揮發性:易揮發
- 化學性質:不穩定
簡介,製備,結構,酸性,反應,存在形式,
簡介
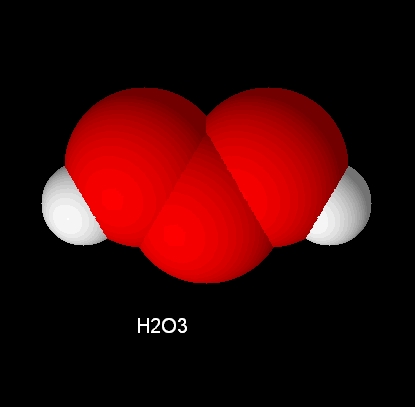 H2O3
H2O3上述反應的逆反應(向水分子中插入單線態氧原子)一般情況下由於單線態氧原子不足而速率小於正反應速率。
理論研究表明,有順式和反式共兩種異構體,其中反式異構體比順式異構體更穩定。二階全活化空間微擾理論(complete active space perturbation theory of second order,CASPT2)預測結果顯示,在單激發態中,順式三氧化二氫壽命最長的激發態為21A",躍遷能為167.43nm,壽命為1.44×10∧-5s;而反式三氧化二氫壽命最長的激發態為21A,其躍遷能為165.52nm,壽命為2.07×10∧-5s。
也就是說,這種物質極易分解,即使是剛製備好的三氧化二氫,沒多久就消失在水中了。
製備
O3與H2O2反應(過臭氧化)的過程也被稱為“過臭氧過程”(Peroxone process)。而O3與H2O2的混合物曾被用作含有各種有機化合物的地下水的處理劑。上述反應也能產生H2O5及一些環狀化合物。
結構
光譜學分析已指出三氧化二氫分子具有曲折的結構(H-O-O-O-H),具有C2對稱性,其中,H2O3O-O鍵的鍵長約為142.8pm,略短於H2O3中的146.4pm。O-H鍵的鍵長為96.6pm,H-O-O鍵角為101.9°,O-O-O鍵角為106.8°,H-O-O-O二面角為81.2°。
酸性
反應
三氧化二氫能與有機硫化物反應生成亞碸,但現在對這類反應的了解仍不多。
存在形式
由於在生命系統中H2O3像臭氧/過氧化氫混合物一樣,也能由人體內的抗體能產生,並利用其強氧化性對抗入侵的細菌等病原體。所以新近的研究認為H2O3是上述混合物中起抗菌作用的活性物質。生命系統中H2O3由免疫細胞產生的單線態氧和水反應獲得(該化學反應的方向視各物質的濃度而定)。
2005年,H2O3被利用微波光譜學在超音速客機中發現,其分子呈現反式構象(trans conformation),其中的O-O鍵短於H2O2中的O-O鍵。
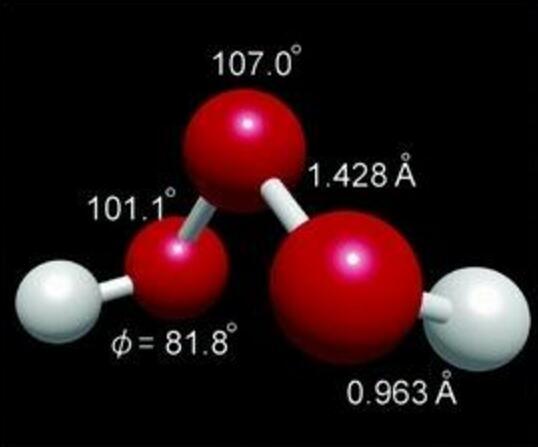
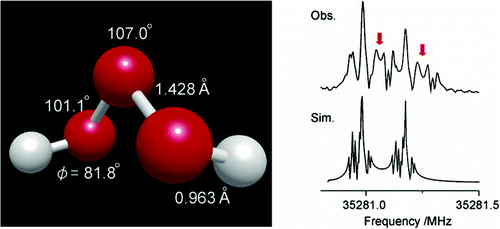 三氧化二氫結構
三氧化二氫結構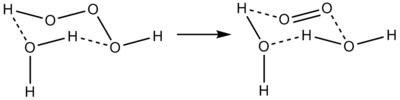 三氧化二氫的分解
三氧化二氫的分解