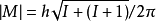介紹
它是一個矢量。當它不是連續變動時,會取不同的分離值,是量子化的。
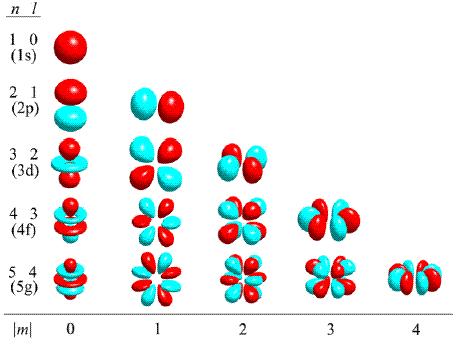
角量子數l確定原子軌道的形狀並在多電子原子中和主量子數一起決定電子的能級。電子繞核運動,不僅具有一定的能量,而且也有一定的角動量M, 它的大小同原子軌道的形狀有密切關係。例如M=0時,即l=0時說明原子中電子運動情況同角度無關,即原子軌道的軌道是球形對稱的;如l=1時,其原子軌道呈啞鈴形分布;如l=2時,則呈花瓣形分布。對於給定的n值,量子力學證明l只能取小於n的正整數:l=0,1,2,3……(n-1) 磁量子數m 磁量子數m決定原子軌道在空間的取向。某種形狀的原子軌道,可以在空間取不同方向的伸展方向,從而得到幾個空間取向不同的原子軌道。
這是根據線狀光譜在磁場中還能發生分裂,顯示出微小的能量差別的現象得出的結果。磁量子數可以取m=0,±1,±2……±l 自旋量子數ms 直接從薛丁格方程得不到第四個量子數——自旋量子數ms,它是根據後來的理論和實驗要求引入的。精密觀察強磁場存在下的原子光譜,發現大多數譜線其實由靠得很近的兩條譜線組成。這是因為電子在核外運動,還可以取數值相同,方向相反的兩種運動狀態,通常用↑和↓表示.
角量子數(azimuthal quantum number)的引入是由於電子繞核運動時,不僅具有一定的能量,而且也具有一定的角動量,角動量的絕對值和角量子數l的關係式為:
對於給定的n值,
量子力學證明l只能取小於n的非負整數:l=0,1,2,3……(n-1) 。
角
量子數決定電子空間運動的
角動量,以及
原子軌道或
電子云的形狀,在多電子原子中與
主量子數n共同決定電子能量高低。對於一定的n值,l可取0,1,2,3,4… n-1等共n個值,用光譜學上的符號相應表示為s,p,d,f,g等。角量子數l表示電子的亞層或能級。一個n值可以有多個l值,如n=3表示第三
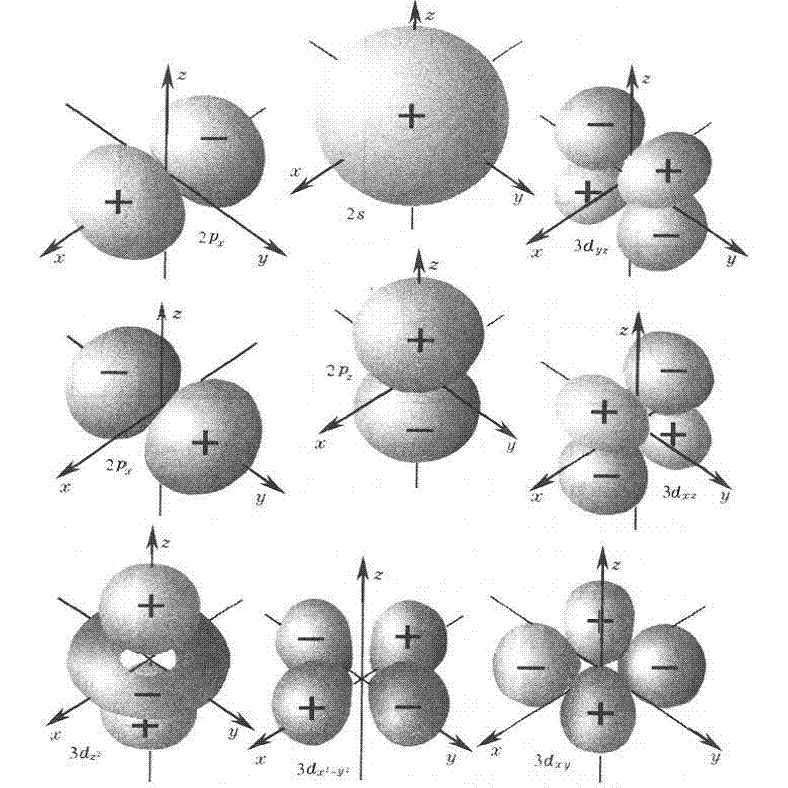
電子層,l值可有0,1,2,分別表示3s,3p,3d亞層,相應的電子分別稱為3s,3p,3d電子。它們的原子軌道和電子云的形狀分別為球形對稱,啞鈴形和四瓣梅花形,對於多電子原子來說,這三個亞層能量為E3d>E3p>E3s,即n值一定時,l值越大,亞層能級越高。在描述多電子原子系統的能量狀態時,需要用n和l兩個
量子數。
作用
角
量子數l確定
原子軌道的形狀並在多電子原子中和
主量子數一起決定電子的
能級。電子繞核運動,不僅具有一定的能量,而且也有一定的
角動量M,它的大小同原子軌道的形狀有密切關係。例如M=0時,即l=0時說明原子中電子運動情況同角度無關,即原子軌道的軌道是球形對稱的;如對於雙原子體系,l=1時,其原子軌道呈啞鈴形分布;如l=2時,則呈花瓣形分布。