非對映異構體以赤式(erythro)和蘇式(threo)標記。赤式異構體是兩個相同取代基在費歇爾投影式中處於同側的異構體,蘇式則相反。
基本介紹
- 中文名:蘇型異構體
- 外文名:threo isomer
- 別名:蘇式異構體
- 學科:化學
- 屬於:非對映異構體
- 來源:蘇阿糖
- 套用:費歇爾投影式
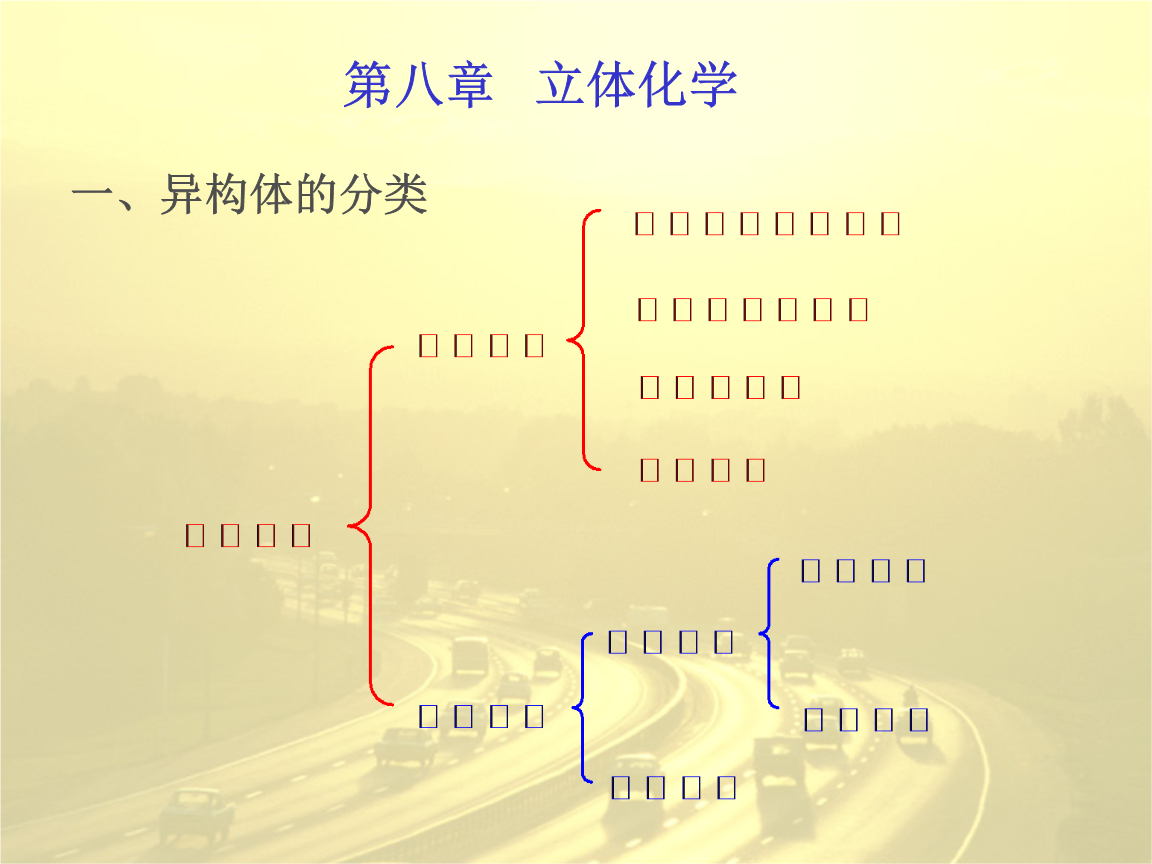
定義,舉例,相關概念,對映異構體,非對映異構體,幾何異構,旋光異構,構象異構,立體化學中赤式與蘇式的描述,Fischer式、鋸架式、飛楔式及Newman 投影式,從橫式飛楔式判斷赤式和蘇式的一般方法,
定義
非對映異構體以赤式(erythro)和蘇式(threo)標記。赤式異構體是兩個相同取代基在費歇爾投影式中處於同側的異構體,蘇式則相反。
舉例
與蘇阿糖構型相似者為蘇式構型;與赤蘚糖構型相似者為赤式構型。例:

相關概念
對映異構體
簡單的說也就是兩個異構體之間的關係就如同一個物體的立體結構在照鏡子,這個立體結構和它在鏡子中的像互為對映異構體。
1、兩個互為鏡像而不能重合的立體異構體,稱為對映異構體,簡稱對映體。
對映體對偏振光的作用不同,它們的比旋光度數值相同,但方向相反。對映體的生物活性不相同,化學反應中表現出等速率。等量的左旋體與右旋體的混合物構成外消旋體。從對映體中分離出單純一個光學異構體的方法稱拆解。最普通的拆解方法是將消旋體與光學活性相反的離子(稱拆解劑)作用生成非對映體。
非對映異構體
兩個結構相同的分子,由於具有構型不同的不對稱原子,彼此不呈實物與鏡像的關係。
非對映異構體是由已含有一個手性中心的分子產生第二個手性中心時的必然產物。與對映體的生成不同,由於第一個手性中心的影響,所得到的兩個非對映異構體的數量並不相同。這就是不對稱合成的基礎。
幾何異構
旋光異構
構象異構
立體化學中赤式與蘇式的描述
Fischer式、鋸架式、飛楔式及Newman 投影式
1891年Fischer在他研究葡萄糖等單糖的立體結構的過程中,首創了現在普遍採用的“Fischer ” 投影結構式。Fischer投影式是將不對稱碳原子上豎向(上下) 所連線的兩個原子或基團朝向紙平面內,橫向(左右) 連線他兩個原子或基團朝向紙平面外所得到的投影式。
例如己d-乳酸Fischer投影式在表示含有一個不對稱碳原子的化合物的立體結構時是很適宜的。但這種投影式只能在紙面上轉動n x 180 ( n = 1 , 2 , 3 )而不能使之翻轉。Fischer投影式描述的立體結構全是重迭式構象,即各基團全部是相互“ 重迭” 的,達到了分子內基團間最擁擠的程度,然而,分子的真正形象卻很少是這個樣子,而是更傾向於各個基團相互錯開一個60角成為“ 交叉” 式的穩定構象式,這種構象勢壘最低。為了用不同方式描述分子的立體異構,人們除了採用Fischer式外還採用了鋸架式、飛楔式和Newman 投影式。如圖4、5所示:

以上的幾種結構式為同一個化合物d一蘇阿糖的分子立體結構的幾種表示法。從這四種形式看,以飛楔式較接近於所表達的分子的立體形象的真實狀態,而Newman投影式卻最能確鑿地表示出兩個直接相連的碳原子上的各個基團在空間所處的向位和關係。
Newman 投影式是表示相鄰兩個原子連線的基團之間空間關係的。所使用的表示方式如上圖中IVa,其中的實線表示原子或基團連線在前面的碳原子上,不完全的線表示原子或基團連線在後面的碳原子上。鋸架式能轉變成紐曼投影式IVa 。因為連線兩個碳原子的單鍵可以自由旋轉,所以IVa只是這個立體異構體的多種表示方式之一。但在討論具有兩個相同手性碳原子的對映異構體的穩定性時,Newman 投影式的優越性便能明顯地表現出來。例如在圖6 內消旋體的三種交叉構象中:

(l)比(II) 和(III) 都穩定。
對映體之一的交叉構象如圖7一般以(IV) 最穩定:

內消旋(I) 和旋光性的(IV),兩種最穩定的構象的不同在於(I)中2個S一M 鄰位交叉的相互作用,而旋光性的(IV) 中則有M 一M 和S 一S鄰位交叉的相互作用。根據一般原理,立體的相互作用是( M 一M ) + ( S 一S )大於 ( M 一S )。故內消旋一般比相應的旋光性異構體穩定(只考慮純立體因素影響)。內消旋(I)相當於赤型,(IV) 則相當於蘇型。赤型往往比蘇型穩定。
從橫式飛楔式判斷赤式和蘇式的一般方法
(1)在全重迭式的構象中,若兩個相鄰的不對稱碳上連有兩組相同的原子或原子團時相同基團完全重迭者(即按實線對實線、楔形線對楔形線、虛線對虛線的重迭方式) 為赤式;反之兩個手性碳上相同基團不能全重迭者為蘇式。
(2)若兩個相鄰的不對稱碳原子上僅連有一組相同的原子或原子團時,判斷其赤式和蘇式,習慣的方法是先令其分子中的官能即(即參與反應的原子或原子團) 彼此重疊,其餘兩組原子或原子團分別按相同一相異原子(或原子團) 重迭者為赤式,相異一相異原子( 或原子團) 重迭者為蘇式。
(3)這裡必須指出,用習慣的投影式的寫法,無論對開鏈的或環狀的(多指平面環)都沒有考慮它們最穩定的構象式。對映體的構型只是為了識別分子空間排布的特點。直鏈狀化合物中,根根動態立體化學原理,分子會產生種種構象(如最典型的九種構象:反交叉式,部分重迭式,順交叉式,全重迭式等等),在幾種典型構象中反交叉式構象能量最低,最穩定,這類產物生成最多。赤式便是反交叉式,也是交叉式中最穩定者,而蘇式屬順交叉式,故不及赤式穩定。但是蘇式又是順交叉式中較穩定者。