葉立德(Ylide),又稱鎓內鹽, 指由供電子的Lewis結構(類似於配位鍵)形成的正負電荷處於鄰位,且均滿足八電子結構的內鹽分子。通常地,葉立德可以寫成共振式,其中一個共振雜化體具有雙鍵。
1953Wititg 和Giessler發現二苯酮和亞甲基三苯膦作用,得到幾乎定量的不對稱二苯乙烯。這個發現立即引起了合成有機化學家的重視,稱之為Wittig 反應。
基本介紹
- 中文名:葉立德
- 外文名:Ylide
- 組成:磷葉立德等
- 別名:鎓內鹽
- 學科:化學
- 屬性:鹽
葉立德(Ylide),又稱鎓內鹽, 指由供電子的Lewis結構(類似於配位鍵)形成的正負電荷處於鄰位,且均滿足八電子結構的內鹽分子。通常地,葉立德可以寫成共振式,其中一個共振雜化體具有雙鍵。
1953Wititg 和Giessler發現二苯酮和亞甲基三苯膦作用,得到幾乎定量的不對稱二苯乙烯。這個發現立即引起了合成有機化學家的重視,稱之為Wittig 反應。
葉立德(Ylide),又稱鎓內鹽, 指由供電子的Lewis結構(類似於配位鍵)形成的正負電荷處於鄰位,且均滿足八電子結構的內鹽分子。通常地,葉立德可以寫成共振式,其中...
葉立德(Ylide),又稱鎓內鹽, 指由供電子的Lewis結構(類似於配位鍵)形成的正負電荷處於鄰位,且均滿足八電子結構的內鹽分子。通常地,葉立德可以寫成共振式,其中...
磷葉立德通式為的一類化合物,由三級膦與鹵代烴反應,經強鹼(如苯基鋰)處理而得,一般均不經離析而直接用於後續合成反應,由於有相反電荷共存於共價鍵分子內,使之表現...
砷葉立德編輯 鎖定 本詞條由“科普中國”百科科學詞條編寫與套用工作項目 審核。自Wittig 反應問世以來,人們對磷Ylide進行了廣泛而深入的研究,但對與之相類似的砷...
硒葉立德scl}0nonium i}lidc由二烷基硒與鹵代烴等反 R 1 R3應生成的兩性離子化合物、其通式為\吸廠代,/。決 R:彬與C之間除了朴電吸引外,反動用d軌道使C...
烯二炔抗癌藥的新合成方法和活化機理及胂葉立德的不對稱Wittig反應的研究的學科專業有機化學,學位級別,d 1997n,學位授予單位,杭州大學。...
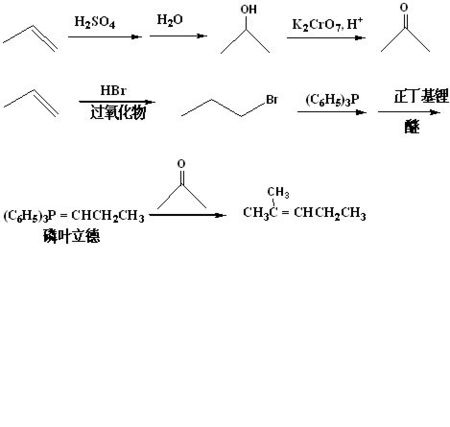
羰基用磷葉立德變為烯烴,稱Wittig 反應(葉立德反應、維蒂希反應)。這是一個非常有價值的合成方法,用於從醛、酮直接合成烯烴 。...
維蒂希反應(Wittig反應)是醛或酮與三苯基磷葉立德(維蒂希試劑)作用生成烯烴和三苯基氧膦的一類有機化學反應,以發明人德國化學家格奧爾格·維蒂希的姓氏命名。...
承擔碩士生《物理有機化學》、《雜環化學》及《葉立德化學》的教學。主持2002年國家自然基金項目“線粒體呼吸抑制劑的合成與構效關係”,曾先後主持並完成了1995年...
(Pfitzner-Moffatt氧化反應、Moffatt氧化反應)以二甲基亞碸(DMSO)和碳二亞胺(失水劑,如二環己基碳二亞胺(DCC))混合物作氧化劑,經由烷氧基鋶葉立德中間體,將一...
亞甲基三苯基膦 一種磷葉立德,橙色固體。由三苯摹麟與澳甲烷在乙醚 ,反應得到葉立德濱化物co3·(+?CH3"P(CfiHs)3'Br}',後者與丁基銼反應即得本品。...
硫葉立德是比較常用的有機合成試劑,它們與醛、酮、α,β-不飽和醛酮反應生成環氧乙烷衍生物,與雙鍵碳原子上連有酯基、硝基、氰基等吸電子基的烯烴反應生成環...
內鎓鹽(ylid or ylide)又叫葉立德,是一種以碳負離子為中心的特殊的兩性離子。...... 內鎓鹽(ylid or ylide)又叫葉立德,是一種以碳負離子為中心的特殊的兩...
LR與氮葉立德的反應,其產物決定於氮葉立德上的取代基。如毗睫基苯甲酞葉立德(93)(R=H,一H3,P一H3)與LR反應得到兩種產物。[1] ...
鋶葉立德對底物親核加成形成兩性中間體(決速步),再經電子轉移並同時離去二甲基亞碸或二甲硫醚,從而生成三元環化合物。...
Johnson-Corey-Chaykovsky反應 環氧化物 硫葉立德試劑 氧-Diels-Alder反應 吡喃 醛在適合的催化劑條件下,可參與環加成反應。這種醛能夠作為二烯的親核物得到吡喃...
魏悌錫試劑,又稱為Witting試劑。亦稱之為磷葉立德(phosphous ylide)魏悌錫試劑是由親核性的三苯基膦【(C6H5)3P】與鹵代烷進行親核取代反應製得的膦鹽,再用...
(C6H5)3PCR′R″(C6H5)3R′R″前者稱葉林,後者稱葉立德(R′、R″為不同的烷基)。葉林結構表示分子的極性小,在磷外圍有10個電子,意味著磷的d軌道也...
1. 國家自然科學基金面上項目:基於芳炔與碘葉立德反應及其套用的研究2. 教育部博士點新教師基金:基於鄰三甲基矽芳基三氟磺酸酯為芳炔的前體與碘葉立德反應的...
