基本介紹
- 中文名:腐蝕電池
- 外文名:Corrosion battery
- 陽極過程:[Mn+ ⋅ne]→Mn+ + ne
- 陰極過程:D + ne→[D⋅ ne]
- 金屬中:電子從陽極到陰極
概述
類型
工作歷程
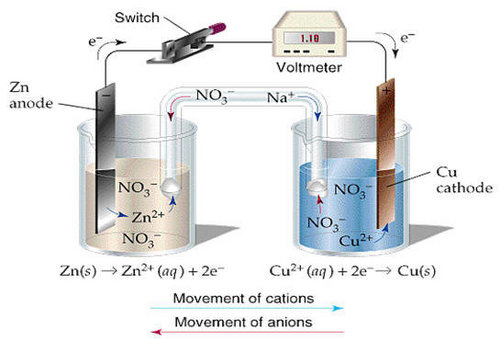
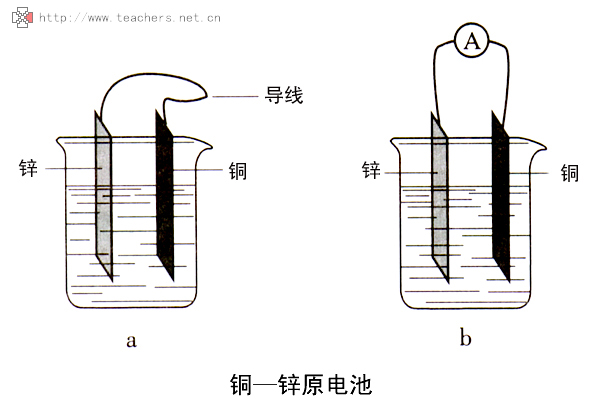

由陽極、陰極、電解質溶液和電子迴路組成的只能導致金屬材料破壞而不能對外界作有用功的短路原電池。...
微觀腐蝕電池是指在金屬表面上由於存在許多微小的電極而形成的腐蝕電池。它是因金屬表面的電化學的不均勻性所引起的,如金屬化學成分的不均勻性;合金組織結構不均勻...
根據組成腐蝕電池的電極尺寸大小及陰、陽極區分布隨時間的穩定性,並考慮到促使形成腐蝕電池的影響因素和腐蝕破壞的特徵,一般可將腐蝕電池分為三大類:巨觀腐蝕電池、...
特性 又稱短路原電池(s}c}rl Circuitcell)。一種金屬或合金浸在電解質溶液中時,由於種種原因(如金屬中存有雜質,同一材料的變形程度、溫度、介質濃度不同等)...
蓄電池在使用過程中出現正極板柵腐蝕損壞,造成蓄電池壽命終結,稱為電池腐蝕。...... 蓄電池在使用過程中出現正極板柵腐蝕損壞,造成蓄電池壽命終結,稱為電池腐蝕。...
電化學腐蝕就是金屬和電解質組成兩個電極,組成腐蝕原電池。例如鐵和氧氣,因為鐵的電極電位總比氧的電極電位低,所以鐵是負極,遭到腐蝕。特徵是在發生氧腐蝕的表面...
多電極腐蝕電池:nulii-electrode }}}rrosian }}c"li多於兩個 金,r}相組成的腐蝕電池系統、若這些金屬相單獨存}}flf的電 位分別為甲。,甲:,一?、,則該...
內容簡介腐蝕電化學是以腐蝕電極為研究對象的電化學,本書系統地闡述了腐蝕電化學的基本原理和研究方法。書中首先深入淺出地討論了電極電位等基本概念和腐蝕電極的...
中文名稱 濃差腐蝕電池 英文名稱 concentration cor rosion cell 定義 由電極表面附近腐蝕劑之濃度差異引起的電位差而形成的腐蝕電池。 套用學科 機械工程(一級...
氧濃差電池腐蝕 同-金屬的不}NJ部位與含氧量不同的溶e}相接觸,形成氧濃差電池(又稱充氣不均勻電池)而導致的腐蝕)這是局部腐C}?.的重要囚素之·例如,盛放...
腐蝕是指(包括金屬和非金屬)在周圍介質(水、空氣、酸、鹼、鹽、溶劑等)作用下產生損耗與破壞的過程。腐蝕是一個漢語辭彙,讀音為fǔ shí,本為化學用詞,指物質...
定義 把腐蝕電池中,陰陽極過程理淪極化由線繪製在同一個電位一電流坐標上作出的圖。從該圖中可以定出該體系的腐蝕電位和最大的腐蝕電流。從陰陽極的起始電位差值...
《腐蝕電化學原理》是曹楚南編著,化學工業出版社出版的一本書籍,本書適合腐蝕工程科技工作者,高等學校材料專業、電化學專業的教師和學生閱讀參考。...
特點 腐蝕電池中進行氧化反應的電極。在陽極上,金屬溶解以離子的形式進人熔液,新把當量的電子留在金屬上。按照這種電化學歷程,金屬的腐蝕破壞將集,}“地出現在...
腐蝕電位是在沒有外加電流時金屬達到一個穩定腐蝕狀態時測得的電位,它是被自腐蝕電流所極化的陽極反應和陰極反應的混合電位,此時金屬上發生的共軛反應是金屬的溶解...
金屬材料受周圍介質的作用而損壞,稱為金屬腐蝕(Metallic Corrosion)。金屬的鏽蝕是最常見的腐蝕形態。腐蝕時,在金屬的界面上發生了化學或電化學多相反應,使金屬轉入...
金屬氧化物-金屬混成電池是由陽極、陰極、電解質溶液和電子迴路組成的只能導致金屬材料破壞而不能對外界作有用功的短路原電池,是一種化學腐蝕類型的電池。在金屬的...
溫差電池腐蝕differential temperature cell corrosion通常是由於浸入電解液的金屬處於不同溢度卜形成溫差電池而導致的腐蝕。...
腐蝕性是指金屬與環境間的物理和化學相互作用,使金屬性能發生變化,導致金屬,環境及其構成系功會受到損傷的現象。腐蝕可分為濕腐蝕和乾腐蝕兩類。...
接觸腐蝕又稱電偶腐蝕。兩種不同的金屬相互接觸而同時處於電解質中所產生的電化學腐蝕。由於它們構成自發電池,故受腐蝕的是較活潑的及作為陽極的金屬。例如,用鐵...
金屬腐蝕主要是電化學腐蝕和化學腐蝕。...... 電化學腐蝕是微電池的存在造成微電池腐蝕,是金屬腐蝕的主要原因。工業腐蝕非金屬腐蝕原理 絕大多數非金屬材料是非電導體...
電化腐蝕防護,是指金屬在與周圍介質作用下,因發生化學反應或電化學反應而引起的破壞稱為金屬腐蝕。單純因發生化學反應而引起的腐蝕稱化學腐蝕;當金屬和電解質溶液...
均勻腐蝕是指接觸腐蝕介質的金屬表面全面產生腐蝕的現象。均勻腐蝕使金屬截面不斷減少,對於被腐蝕的受力零件而言,會使其承受的真實應力逐漸增加,最終達到材料的斷裂...
