《胃癌診療規範(2011年版)》由衛生部於2011年2月16日衛辦醫政發〔2011〕20號發布。並且在2012年對其“腫瘤分型綜合治療體系”做了補充。
基本介紹
- 中文名:胃癌診療規範
- 發布單位:衛生部
- 發布時間:2011年2月16日
- 補充時間:2012年
概述,診斷,輔助檢查,鑑別診斷,治療,診療流程,隨訪,專家組,組長,參加人員,
概述
胃癌是我國最常見的惡性腫瘤之一,2010年衛生統計年鑑顯示,2005年,胃癌死亡率占我國惡性腫瘤死亡率的第3位。胃癌的發生是多因素長期作用的結果。我國胃癌發病率存在明顯地區差異,環境因素在胃癌的發生中居支配地位,而宿主因素則居從屬地位。有研究顯示,幽門螺旋桿菌(Helicobacterpylori, H.pylori)感染、飲食、吸菸及宿主的遺傳易感性是影響胃癌發生的重要因素。
為進一步規範我國胃癌診療行為,提高醫療機構胃癌診療水平,改善胃癌患者預後,保障醫療質量和醫療安全,特制定本規範。本規範所稱的胃癌是指胃腺癌(以下簡稱胃癌),包括胃食管結合部癌。
診斷
應當結合患者的臨床表現、內鏡及組織病理學、影像學檢查等進行胃癌的診斷和鑑別診斷。
(一)臨床表現
胃癌缺少特異性臨床症狀,早期胃癌常無症狀。常見的臨床症狀有上腹部不適或疼痛、食慾減退、消瘦、乏力、噁心、嘔吐、嘔血或黑便、腹瀉、便秘、發熱等。
(二)體徵
輔助檢查
1.內鏡檢查
(1)胃鏡檢查:確診胃癌的必須檢查手段,可確定腫瘤位置,獲得組織標本以行病理檢查。必要時可酌情選用色素內鏡或放大內鏡。
(3)腹腔鏡:對懷疑腹膜轉移或腹腔內播散者,可考慮腹腔鏡檢查。
2.組織病理學診斷
組織病理學診斷是胃癌的確診和治療依據。活檢確診為浸潤性癌的患者進行規範化治療。如因活檢取材的限制,活檢病理不能確定浸潤深度,報告為癌前病變或可疑性浸潤的患者,建議重複活檢或結合影像學檢查結果,進一步確診後選擇治療方案。
(1)胃鏡活檢標本處理。
①標本前期處置:活檢標本離體後,立即將標本展平,使黏膜的基底層面貼附在濾紙上。
③石蠟包埋:去除濾紙,將組織垂直定向包埋。
④HE製片標準:修整蠟塊,要求連續切6~8個組織面,撈取在同一張載玻片上。常規HE染色,封片。
(2)病理診斷標準。
①低級別上皮內腫瘤:黏膜內腺體結構及細胞學形態呈輕度異型性,與周圍正常腺體比較,腺體排列密集,腺管細胞出現假復層,無或有極少粘液,細胞核染色濃重,出現核分裂相。
④黏膜下癌:即黏膜內浸潤癌繼續向深層浸潤,侵透黏膜肌層達到黏膜下層,未侵及胃固有肌層。
⑤早期胃癌(T1N0/1M0):包括黏膜內浸潤癌和黏膜下浸潤癌,無論有無區域淋巴結轉移證據。
(3)病理評估。
①組織標本固定標準。
固定液量:必須大於所固定標本體積的10倍。
固定溫度:正常室溫。
固定時間:內鏡活檢標本或黏膜切除標本:大於6小時,小於48小時。胃切除手術標本:沿胃大彎剖開展平固定,固定時限為大於12小時,小於48小時。
②取材要求。
A.活檢標本。
核對臨床送檢標本數量,送檢活檢標本必須全部取材。每個蠟塊內包括不超過5粒活檢標本。將標本包於紗布或柔軟的透水紙中以免丟失。
B.內鏡下黏膜切除標本。
送檢標本由手術醫師展平固定,標記方位。記錄腫瘤的大小,各方位距切緣的距離。垂直於胃壁,每間隔0.3cm平行切開標本,分成適宜大小的組織塊,推薦按同一包埋方向全部取材。記錄組織塊對應的方位。
C.胃切除術標本
a.腫瘤及切緣:腫瘤組織充分取材,視腫瘤大小、浸潤深度、不同質地、顏色等區域分別常規取材,腫瘤≥4塊,含腫瘤浸潤最深處1-2塊全層厚度腫瘤,以判斷腫瘤侵犯的最深層次。腫瘤與瘤旁交界部組織1-2塊,觀察腫瘤與鄰近肉眼觀正常黏膜的關係。切取遠端、近端手術切緣,常規至少各1塊。早期癌取材原則:切取全部手術切除標本製片,應當附圖示標記採取組織塊的位置,以便複診或會診時參照。
b.淋巴結:建議外科醫師根據局部解剖和術中所見,分組送檢淋巴結,有利於淋巴結引流區域的定位;在未接到手術醫師分組送檢醫囑或標記的情況下,病理醫師按照以下原則檢出標本中的淋巴結:全部淋巴結均需取材,建議術前未接受治療病例的淋巴結總數應≥15枚。所有肉眼陰性的淋巴結應當完整送檢,肉眼陽性的淋巴結可部分切取送檢。
c.推薦取材組織體積:不大於2×1.5×0.3cm。
D.取材後標本處理原則和保留時限。
a.剩餘標本的保存:取材剩餘組織保存在標準固定液中,並始終保持充分的固定液量和甲醛濃度,避免標本乾枯或因固定液量不足或濃度降低而致組織腐變,以備根據鏡下觀察診斷需求而隨時補充取材,或是在病理診斷報告簽發後接到臨床反饋信息時複查大體標本或補充取材。
b.剩餘標本處理的時限:建議在病理診斷報告簽發1個月後,未接到臨床反饋信息,未發生因外院會診意見分歧而要求複審等情形後,可由醫院自行處理。
(4)病理類型。
①早期胃癌大體類型。
Ⅰ :隆起型
Ⅱa:表面隆起型
Ⅱb:平坦型
Ⅱc:表面凹陷型
Ⅲ :凹陷型
②進展期胃癌的大體類型。
隆起型:腫瘤的主體向腸腔內突出。
潰瘍型:腫瘤深達或貫穿肌層合併潰瘍。
浸潤型:腫瘤向腸壁各層瀰漫浸潤,使局部腸壁增厚,但表面常無明顯潰瘍或隆起。
③組織學類型。
A.WHO分類:目前最為常用的胃癌組織學分型方法(附屬檔案2)。
B.Lauren分類:腸型、瀰漫型、混合型。
(5)病理報告內容。
A.活檢標本的病理報告必須包括以下內容:
a.患者基本信息及送檢信息;
b.上皮內腫瘤(異型增生),報告分級;
c.可疑浸潤:應當重複活檢,必要時應當行免疫組化染色鑑別;
d.早期浸潤性癌:提示浸潤深度。
臨床醫師應當了解受活檢取材深度限制,活檢組織病理檢查可能難以確認實際浸潤深度。
B. 內鏡下黏膜切除標本的病理報告必須包括以下內容:
a.患者基本信息及送檢信息;
b.腫瘤大小;
c.上皮內腫瘤(異型增生)的分級;
d.對浸潤性癌,應當報告組織學分型、分級、浸潤深度、切緣情況和脈管侵犯情況等。
pT1低分化癌、脈管侵犯、切緣陽性,應當再行外科手術擴大切除範圍。其他情況,內鏡下切除充分即可,但術後需定期隨訪。
預後不良的組織學特徵包括:低分化,血管、淋巴管浸潤,切緣陽性。
陽性切緣定義為:腫瘤距切緣小於1mm或電刀切緣可見癌細胞。
C. 手術切除標本的病理報告必須包括以下內容:
a.患者小、大體類型、肉眼所見浸潤深度、上下切緣與腫瘤的距離;
c.腫瘤分化程度(腫瘤分型、分級);
e.檢出淋巴結數目以及陽性淋巴結數目(N分期);
f.近端切緣、遠端切緣的狀況。如果腫瘤距切緣很近,應當在顯微鏡下測量並報告腫瘤與切緣的距離,腫瘤距切緣1mm以內報切緣陽性;
g.脈管和神經侵犯情況;
3.實驗室檢查
(2)尿液、糞便常規、糞隱血試驗。
4.影像學檢查
(1)計算機斷層掃描(CT):CT平掃及增強掃描在評價胃癌病變範圍、局部淋巴結轉移和遠處轉移狀況等方面具有重要價值,應當作為胃癌術前分期的常規方法。在無造影劑使用禁忌證的情況下,建議在胃腔呈良好充盈狀態下進行增強CT掃描。掃描部位應當包括原發部位及可能的轉移部位。
(4)胸部X線檢查:應當包括正側位相,可用於評價是否存在肺轉移和其他明顯的肺部病變,側位相有助於發現心影后病變。
(6)PET-CT:不推薦常規使用。對常規影像學檢查無法明確的轉移性病灶,可酌情使用。
鑑別診斷
治療
治療原則
應當採取綜合治療的原則,即根據腫瘤病理學類型及臨床分期,結合患者一般狀況和器官功能狀態,採取多學科綜合治療(multidisciplinaryteam, MDT)模式,有計畫、合理地套用手術、化療、放療和API特異生物免疫療法等治療手段,達到根治或最大幅度地控制腫瘤,延長患者生存期,改善生活質量的目的。
2.局部進展期胃癌或伴有淋巴結轉移的早期胃癌,應當採取以手術為主的綜合治療。根據腫瘤侵犯深度及是否伴有淋巴結轉移,可考慮直接行根治性手術或術前先行新輔助化療,再考慮根治性手術。成功實施根治性手術的局部進展期胃癌,需根據術後病理分期決定輔助治療方案(輔助化療,必要時考慮輔助化放療)。
手術治療
1.手術治療原則
手術切除是胃癌的主要治療手段,也是治癒胃癌的唯一方法。胃癌手術分為根治性手術與姑息性手術,應當力爭根治性切除。胃癌根治性手術包括早期胃癌的EMR、ESD、D0切除術和D1切除術等,部分進展期胃癌的(D2)及擴大手術(D2+)。胃癌姑息性手術包括胃癌姑息性切除術、胃空腸吻合術、空腸營養管置入術等。
外科手術應當完整切除原發病灶,徹底清掃區域淋巴結。對呈局限性生長的胃癌,切緣距病灶應當至少3cm;對呈浸潤性生長的胃癌,切緣距病灶應當超過5cm。鄰近食道及十二指腸的胃癌,應當儘量完整切除病灶,必要時行術中冰凍病理檢查,以保證切緣無癌殘留。現仍沿用D(dissection)表示淋巴結清除範圍,如D1手術指清掃區域淋巴結至第1站,D2手術指清除掃區域淋巴結至第2站、如果達不到第1站淋巴結清掃的要求,則視為D0手術。
腹腔鏡是發展較快的微創手術技術,在胃癌的套用應當選擇I期患者為宜。
2.術式及適應證
(1)縮小手術。
切除範圍小於標準根治術的各類根治性術式。
①內鏡下黏膜切除術(endoscopic mucosa resection,EMR)和內鏡下黏膜下切除術(andendoscopic submucosa dissection,ESD)適應證:高分化或中分化,無潰瘍,直徑小於2cm,無淋巴結轉移的黏膜內癌。
②胃D1切除術適應證:黏膜內癌直徑超過2cm的,以及侵犯黏膜下層的胃癌。一旦出現淋巴結轉移,應當施行D2切除術。
(2)標準手術。
D2根治術是胃癌的標準術式,腫瘤浸潤深度超過黏膜下層(肌層或以上),或伴有淋巴結轉移但尚未侵犯鄰近臟器的,均應當行標準手術(D2根治術)。
表1.不同部位胃癌D1及D2(標準根治術)的淋巴結清掃範圍
遠端胃切除 | 近端胃切除 | 全胃切除 | |
D1 | 1、3、4sb、4d、5、6、7 | 1、2、3、4sa、4sb、7 | 1--7 |
D2 | D1+8a、9、11p、12a | D1+8a、9、10、11 | D1+8a、9、10、11、12a |
(3)標準手術+聯合臟器切除:腫瘤浸潤鄰近臟器者。
(4)姑息性手術:僅適用於有遠處轉移或腫瘤侵犯重要臟器無法切除而同時合併出血、穿孔、梗阻等情況者。姑息性手術以解除症狀、提高生活質量為目的。
(1)全身狀況無法耐受手術;
(2)局部浸潤廣泛無法完整切除;
(4)存在心、肺、肝、腎等重要臟器功能明顯缺陷、嚴重的低蛋白血症、貧血、營養不良等情況無法耐受手術者。
4.胃癌淋巴結分組、分站標準(附屬檔案4)。
放射治療
1.適應證
胃癌放療或放化療的主要目的包括施行術前或術後輔助治療、姑息治療和改善生活質量。術後放化療的適應證主要針對T3-4或N+(淋巴結陽性)的胃癌;術前放化療的適應證主要針對不可手術切除的局部晚期或進展期胃癌;姑息性放療的適應證為腫瘤局部區域復發和/或遠處轉移。
(2) 局部晚期不可手術切除的胃癌(T4NxM0),可以考慮術前同步放化療,治療後重新評估,爭取行根治性手術;
(3) 胃癌非根治性切除,有腫瘤殘存患者(R1或R2切除),建議行術後同步放化療;
(4) 局部區域復發的胃癌,建議放療或放化療;
.放射治療技術
(1)照射技術。
根據醫院具有的放療設備選擇不同的放射治療技術,如常規放療、三維適形放療、調強放療、圖像引導放療等。建議使用三維適形放療或調強放療等先進技術,更好地保護周圍正常組織如肝、脊髓、腎臟和腸道的照射劑量,降低正常組織毒副作用,提高放療耐受性。
①模擬定位:推薦CT模擬定位。如無CT模擬定位,必須行常規模擬定位。體位固定,仰臥位。定位前3小時避免多食,口服對比劑或靜脈套用造影有助於CT定位和靶區勾畫;
②建議三野及以上的多野照射;
③如果調強放療,必須進行計畫驗證;
④局部加量可採用術中放療或外照射技術;
(2)靶區定義。
①原發腫瘤高危復發區域:包括吻合口和鄰近受侵器官或部位;
②高危區域淋巴結區:根據原發腫瘤部位、腫瘤侵犯深度和淋巴結轉移情況決定;
③鄰近器官:胰腺或部分胰腺區等。
(3)正常組織限制劑量。
(4)照射劑量。
三維適形照射和調強放療套用體積劑量定義方式,常規照射套用等中心點劑量定義模式。
①根治術後原發腫瘤高危復發區域和區域淋巴引流區照射劑量,推薦DT45-50.4 Gy,每次1.8 Gy,共25-28次;
②有腫瘤和/或殘留者,大野照射後局部縮野加量照射DT 5-10 Gy。
化學治療
分為姑息化療、輔助化療和新輔助化療,應當嚴格掌握臨床適應證,並在腫瘤內科醫生的指導下施行。化療應當充分考慮患者病期、體力狀況、不良反應、生活質量及患者意願,避免治療過度或治療不足。及時評估化療療效,密切監測及防治不良反應,並酌情調整藥物和(或)劑量。按照療效評價標準(附屬檔案5)或參照WHO實體瘤療效評價標準評價療效。不良反應評價標準參照NCI-CTC標準。
1.姑息化療
目的為緩解腫瘤導致的臨床症狀,改善生活質量及延長生存期。適用於全身狀況良好、主要臟器功能基本正常的無法切除、復發或姑息性切除術後的患者。
化療方案包括兩藥聯合或三藥聯合方案,兩藥方案包括:5-FU/LV+順鉑(FP)、卡培他濱+順鉑、替吉奧+順鉑 、卡培他濱+奧沙利鉑(XELOX)、FOLFOX 、卡培他濱+紫杉醇、FOLFIRI等。三藥方案適用於體力狀況好的晚期胃癌患者,常用者包括:ECF及其衍生方案(EOX、ECX、EOF),DCF及其改良方案等。對體力狀態差、高齡患者,考慮採用口服氟尿嘧啶類藥物或紫杉類藥物的單藥化療。
2.輔助化療
輔助化療的對象包括:術後病理分期為Ib期伴淋巴結轉移者,術後病理分期為II期及以上者。輔助化療始於患者術後體力狀況基本恢復正常,一般在術後3-4周開始,聯合化療在6個月內完成,單藥化療不宜超過1年。輔助化療方案推薦氟尿嘧啶類藥物聯合鉑類的兩藥聯合方案。對臨床病理分期為Ib期、體力狀況差、高齡、不耐受兩藥聯合方案者,考慮採用口服氟尿嘧啶類藥物的單藥化療。
3.新輔助化療
DC-CIK生物免疫療法
DC-CIK生物免疫治療是目前腫瘤生物治療最成熟的治療方案之一,DC(樹突細胞能夠準確識別腫瘤抗原並將信息傳遞給人體免疫系統,CIK細胞是人體免疫系統中的天然腫瘤殺傷細胞,可通過發揮自身細胞毒性和分泌細胞因子殺傷腫瘤,二者聯合就完成了從辨別敵人(腫瘤細胞)到消滅敵人的全過程。兩者聯合可以顯著抑制腫瘤細胞生長、並逐一消滅腫瘤細胞,最大限度調動患者自身的免疫系統對抗腫瘤。DC-CIK聯合治療的另一大優勢是源源不斷的免疫細胞的輸入,迅速增強了人體免疫系統,可顯改善患者的生活質量,延長腫瘤患者的生存期。
支持治療
目的為緩解症狀、減輕痛苦、改善生活質量,應當在選擇治療方案、判斷療效時統籌考慮,包括糾正貧血、改善營養狀況、改善食慾、緩解梗阻、鎮痛、心理治療等。具體措施包括支架置入、腸內外營養支持、控制腹水、中醫中藥治療等。
診療流程
胃癌診斷與治療的一般流程圖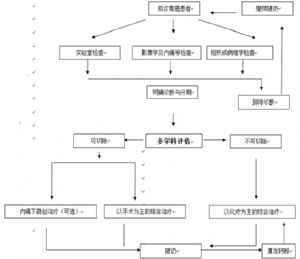 胃癌診療流程圖
胃癌診療流程圖
 胃癌診療流程圖
胃癌診療流程圖隨訪
胃癌患者應當通過監測症狀、體徵和輔助檢查進行定期隨訪。隨訪目的為監測疾病復發或治療相關不良反應、評估改善營養狀態等。隨訪應當包括血液學、影像學、內鏡等檢查項目。
專家組
(按姓氏筆畫排序)
組長
沈 琳
參加人員
潘宏銘 燕 敏
