基本原理,分類,作用,標本,抗體,常用染色方法,操作步驟,操作步驟,化染色步驟,判定分析,意義,免疫組化鏡檢,細胞凋亡檢測,關於掉片,經驗總結,實驗為例,免疫個人感悟,
基本原理
抗體和抗原之間的結合具有高度的特異性,免疫組織化學正是利用了這一原理。先將組織或細胞中的某種化學物質提取出來,以此作為抗原或半抗原,通過免疫動物後獲得特異性的抗體,再以此抗體去探測組織或細胞中的同類的抗原物質。由於抗原與抗體的複合物是無色的,因此還必須藉助於組織化學的方法將抗原抗體結合的部位顯示出來,以其達到對組織或細胞中的未知抗原進行定性,定位或定量的研究。
分類
免疫組織化學技術按照標記物的種類可分為
免疫螢光法、免疫酶法、免疫鐵蛋白法、免疫金法及放射免疫自顯影法等。
這些常用免疫組織化學方法的原理如下:
1. 免疫螢光細胞化學技術
將已知抗體標上螢光素,以此作為探針檢查細胞或組織內的相應抗原,在螢光顯微鏡下觀察.當抗原抗體複合物中的螢光素受激發光的照射後會發出一定波長的螢光,從而可以確定組織中的抗原定位或定量.
2. 免疫酶細胞化學技術
是目前免疫組織化學研究中最常用的技術.基本原理是先以酶標記的抗體與組織或細胞作用,然後加入酶的底物,生成有色的不溶性產物或具有一定電子密度的顆粒,通過光鏡或電鏡,對細胞或組織內的相應抗原進行定位或定性研究.
3. 免疫膠體金技術
就是用膠體金標記一抗,二抗或其他的能特異性的結合免疫球蛋白的分子(如葡萄球菌A蛋白)等作為探針對組織或細胞內的抗原進行定性,定位或定量研究.由於膠體金的電子密度高,多用於免疫電鏡的單標記或多標記的定位研究.
作用
標本
實驗所用主要為組織標本和細胞標本兩大類,前者包括
石蠟切片(病理切片和組織晶片)和
冰凍切片,後者包括組織印片、細胞爬片和細胞塗片。
其中石蠟切片是製作組織標本最常用、最基本的方法,對於組織形態保存好,且能作
連續切片,有利於各種染色對照觀察;還能長期存檔,供回顧性研究;石蠟切片製作過程對組織內
抗原暴露有一定的影響,但可進行
抗原修復,是免疫組化中首選的組織標本製作方法。
抗體
免疫組化實驗中常用的抗體為
單克隆抗體和多克隆抗體,單克隆抗體是一個B淋巴細胞克隆分泌的抗體,套用細胞融合
雜交瘤技術免疫動物製備。多克隆抗體是將純化後的抗原直接免疫動物後,從動物血中所獲得的免疫血清,是多個B淋巴細胞克隆所產生的抗體混合物。
常用染色方法
根據
標記物的不同分為免疫螢光法,免疫酶標法,親和組織化學法,後者是以一種物質對某種組織成分具有高度
親合力為基礎的檢測方法。這種方法敏感性更高,有利於微量抗原(抗體)在細胞或
亞細胞水平的定位,其中
生物素—抗生物素染色法最常用。
操作步驟
一 免疫組化(SP法)操作步驟
1. 切片常規脫蠟至水。如需抗原修復,可在此步後進行
2.緩衝液洗 3min/2 次。
3. 為了降低內源性
過氧化物酶造成的非特異性背景染色,將切片放在 Hydrogen Peroxide Block 中孵育 10-15 分鐘。
4. 緩衝液洗 5min/2 次。
5. 滴加 Ultra V Block , 在室溫下孵育 5 分鐘以封閉非特異性的背景染色。
(註:孵育不要超過 10 分鐘,否則會導致特異性染色降低。如果一抗的
稀釋液中含有 5 - 10% 正常羊血清,這一步可以省略。)
6. 緩衝液洗 5min/2 次。
7. 滴加一抗工作液 37 ℃
孵育 1 - 2 小時。(具體孵育時間和溫度由試驗者最終決定)
8. 緩衝液洗 5min/2 次。
9 . 滴加 Primary Antibody Enhancer(
增強子),在室溫下孵育 20 分鐘。
10 .緩衝液洗 5min/2 次。
11 .滴加 HRP Polymer(酶標二抗) ,在室溫下孵育 30 分鐘。
(註:HRP Polymer 對光敏感,應避免不必要的光暴露並儲存在不透明的小瓶中。)
12 .緩衝液洗 5min/2 次。
13 .向 1ml DAB Plus Substrate (或 AEC Plus Substrate) 中滴加 1-2 滴 DAB Plus Chromogen (或 AEC Plus Chromogen),混勻後滴加到切片上,孵育 3 - 15 分鐘。(具體時間由染色深淺決定。)
14 .自來水充分沖洗,復染,脫水,透明,封片。
操作步驟
⑴、石蠟切片脫蠟至水。
⑵、 3%H 2 O2 室溫孵育 5-10 分鐘,以消除內源性過氧化物酶的活性。
⑶、蒸餾水沖洗, PBS 浸泡 5 分鐘 x2 (如需抗原修復,可在此步後進行)。
⑷、 5-10% 正常山羊血清(PBS 稀釋)封閉,室溫孵育 10 分鐘,傾去血清,勿洗。滴加 一抗 工作液, 37 ℃ 孵育 1-2 小時或 4 ℃ 過夜。
⑸、 PBS 沖洗, 5 分鐘 x3 次。
⑹、滴加適量 生物素標記二抗 工作液, 37 ℃ 孵育 10-30 分鐘。
⑺、 PBS 沖洗, 5 分鐘 x3 次。
⑻、滴加適量的 辣根酶或鹼性磷酸酶標記的鏈霉卵白素 工作液, 37 ℃ 孵育 10-30 分鐘。
⑼、 PBS 沖洗, 5 分鐘 x3 次。
⑽、
顯色劑顯色 3-15 分鐘(DAB 或 NBT/BCIP)
⑾、自來水充分沖洗,復染,脫水,透明,封片。
化染色步驟
冰凍切片 4-8μm ,室溫放置 30 分鐘後,入 4 ℃丙酮固定 10分鐘,PBS洗,5分鐘x3,用過氧化氫孵育5-10分鐘,消除內源性過氧化物酶的活性。
判定分析
從實驗結果而言,
免疫組化技術服務主要涉及抗體實驗結果的描述與分析,圖片的確定與選取,相關數據的提供,上述工作是免疫組化工作的重點內容,只有嚴格的實驗設計,標準的實驗操作,專業化的結果分析才能更好的滿足客戶的要求,這點對於形式為腹水,上清,培養液之類的抗體顯得更為重要。關於上述服務內容應該在實驗開始前由雙方明確,一般而言,客戶方實驗前應提出需要什麼樣的結果與分析,例如是簡要還是詳細的描述實驗結果,需要實驗數據否,圖片的數量與規格等。如果為雙盲試驗或有第三方參與,則事先申明。
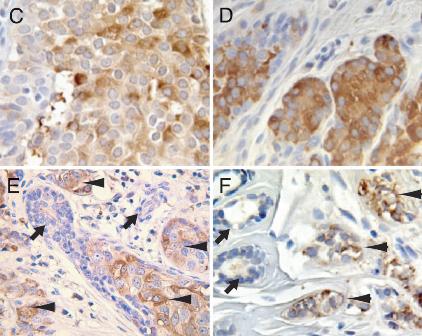 免疫組化染色(IHC)
免疫組化染色(IHC)意義
近年來,隨著
免疫組織化學技術的發展和各種特異性抗體的出現,使許多疑難腫瘤得到了明確診斷。在常規腫瘤病理診斷中,5%-10%的病例單靠H.E.染色難以作出明確的
形態學診斷。尤其是免疫組化在腫瘤診斷和鑑別診斷中的實用價值受到了普遍的認可,其在低分化或未分化腫瘤的鑑別診斷時,準確率可達50%-75%。

免疫組織化學的臨床套用主要包括以下幾方面:
⑴惡性腫瘤的診斷與鑑別診斷;
⑵確定轉移性惡性腫瘤的原發部位;
⑶對某類腫瘤進行進一步的病理分型;
⑷軟組織腫瘤的治療一般需根據正確的
組織學分類,因其種類多、組織形態相像,有時難以區分其組織來源,套用多種標誌進行免疫組化研究對軟組織腫瘤的診斷是不可缺少的;
⑸發現微小轉移灶,有助於臨床治療方案的確定,包括手術範圍的確定。
⑹為臨床提供治療方案的選擇。
免疫組化鏡檢
在鏡檢前可以通過相關資料查詢抗體的表達部位:細胞間質、細胞膜、細胞漿、
核膜、細胞核以及在其中的多個部位表達(如:MPO抗體表達在細胞膜、細胞漿、核膜、細胞核上)和表達組織(如:VWF抗體在血管壁上表達,呈現環形)。
在顯微鏡下觀察時,先在4倍鏡下查找組織及其範圍,然後查看整個組織確定陽性產物的表達部位,然後將陽性產物表達部位置於視野正中央,換高倍鏡觀察。
細胞凋亡檢測
細胞凋亡原理:正常凋亡細胞通過檢測凋亡細胞DNA片段進行染色,正常的、人為造成凋亡的細胞很少能夠被染色。以甲基綠復染,便於從形態學上分辨評估正常細胞和凋亡細胞。
首先確定目標凋亡細胞的組織部位(如眼球組織,由於玻璃體結構內沒有細胞核,因此看不到凋亡,在整個組織的最外面有單層視網膜細胞,因此只能在最邊緣查看凋亡細胞的陽性產物)
關於掉片
HE、Masson、
番紅O、Nissl、Mallory等染色方法很少有掉片現象;免疫組化和細胞凋亡檢測我們採用專門購買的
防脫片,由於整個實驗流程比較長,在實驗過程中產生掉片是很正常的現象。對於容易掉片的組織,如:
骨組織、腦組織、皮膚組織等掉片有時候是不可避免的。
經驗總結
做過病理實驗的人都知道,實驗看似容易,但真想把它做好,還是需要花上很長一段時間去積累和摸索經驗。我從事病理實驗已有6年多了,在這段時間裡,我做過許許多多病理相關實驗,剛開始啥也不懂,一味按照網上操作流程來做,但做的結果往往並不是十分理想,最終結果未能達到預期的效果。經過一段時間的瀏覽和學習,從一些在論壇內學習、請教,並結合實踐操作,我經歷了初級——查找資料和摸索方法;中級——問題求助和不斷總結;高級——難題解答和經驗分享這三個階段,也學到了不少知識,積累了很多寶貴經驗,與大家一起分享下。
實驗為例
從我接觸的很多本科生和研究生中發現,他們的確是免疫組化“新手”,他們只注重如何做和最終的結果,但對為什麼這樣做不太感興趣。他們常按照網上所說的方法,摸索好的抗體濃度和條件後做出很漂亮的染色結果後,他們就認為自己已經掌握了免疫組化方法了,結果不求上進,更換一種新抗體後或實驗出現異常結果後就很難做出來了。當然,免疫組化對於我來說,做過很多,但也不能說什麼都會,只不過我做的多了,失敗多了和思考多了,可能比新手多了解一些其中的訣竅,拿來與大家進行分享。此外,我個人經驗不可能面面俱到,還需要更多有經驗的高手一起分享、糾正和補充。在這裡,我需要感謝中華病理網、丁香通、小木蟲論壇給我很大的幫助,還有上海舜田生物技術人員老師給我實驗很多指導和幫助,讓我受益匪淺。
免疫個人感悟
1、其實免疫組化,我個人感覺方法和操作都不是很難,關鍵是結果出現異常時該如何去解決?我認為首先需要掌握好免疫組化實驗的原理,知道每一個操作步驟的目的,這樣你才能大膽地去改革和糾正一些錯誤的步驟,如抗體孵育條件主要是抗體濃度、溫度、時間,這三者一般是相互成反比的(相對),其中濃度是最重要的先決條件,溫度決定反應的速度、時間決定反應的量。比如溫度有4℃、室溫、37℃。我推薦4℃最佳,反應最溫和,背景較淺;而37℃反應速度較快,時間較短;室溫我不太提倡,除非你每次都把環境溫度控制在一定的範圍,否則,儘量選擇前兩者。
2、定位和定性是免疫組化最大的優勢。相比於其他蛋白檢測方法,免疫組化具有定位較直接準確、定性靈敏度高,是定位檢測分析首選方法。尤其對於有些因子的轉位研究十分有用。
3、免疫組化結果
定量分析的前提是高質量的染色切片。免疫組化結果也能定量分析,但必須是背景染色淺而特異性染色較深的情況下,分析最為準確,這種原則可能也是我們日常審稿時判定研究結果的必備條件。
4、免疫組化實驗一定要設定陽性和
陰性對照。陽性對照一般是用肯定表達這種抗原的切片來做;陰性對照一般是用PBS或非一抗替代一抗來進行反應,其餘步驟均一致。前者是排除方法和實驗系統有無問題;後者是排除有無一抗外的非特異性染色。
5、免疫組化技術掌握與否的鑑定標準是同一切片或不同切片中不同抗原均從摸索濃度或條件而做出優良的染色切片。我發現許多研究生把網上或者說明書摸索的反應條件、濃度、方法步驟,重複運用於同一性質的切片和同一種抗體,做出來後就覺得自己已經掌握了免疫組化方法,更換一種抗體後,居然連二抗的種屬來源都拿錯了。失敗往往促進你去思考試驗原理和過程,成功有時也讓自己很自傲。
6、免疫組化的套用廣泛,是當前實驗研究的最重要方法之一。如今發SCI論文時,明顯感覺僅靠量化的數據來發文章很難,加一些形態學數據或圖片,老外十分歡迎,可能是怕你學術造假吧。當然也不能做假陽性或假陰性結果。
7、實驗方法需要動手和動腦。經過了反覆的動手和動腦,把理論原理運用於實踐,在把實踐中發現的問題帶到理論知識中去解決,最終把理論與實踐融會貫通。必要時去各大論壇或者一些知名公司尋求幫助,個人感覺上海舜田生物技術支持不錯,服務質量也很好。
下面先介紹下免疫組化的概念和常用方法,以便讓大家對免疫組化更深入地理解和掌握。
概念和常用方法介紹
1、定義
用標記的
特異性抗體對組織切片或細胞標本中某些化學成分的分布和含量進行組織和細胞原位定性、定位或定量研究,這種技術稱為免疫組織化學(immunohistochemistry)技術或
免疫細胞化學(immunocytochemistry)技術。
2、原理
根據
抗原抗體反應和化學顯色原理,組織切片或細胞標本中的抗原先和一抗結合,再利用一抗與標記生物素、
螢光素等的二抗進行反應,前者再用標記辣根
過氧化物酶(HRP)或
鹼性磷酸酶(AKP)等的抗生物素(如鏈霉
親和素等)結合,最後通過呈色反應或螢光來顯示細胞或組織中化學成分,在光學顯微鏡或螢光顯微鏡下可清晰看見細胞內發生的抗原抗體反應產物,從而能夠在細胞爬片或組織切片上原位確定某些化學成分的分布和含量。
3、分類
2)按染色步驟可分為直接法(又稱一步法)和間接法(二步、三步或多步法)。與直接法相比,間接法的靈敏度提高了許多。
3)按結合方式可分為抗原-抗體結合,如過氧化物酶-抗過氧化物酶(PAP)法;親和連線,如
卵白素-生物素-過氧化物酶複合物(ABC)法、鏈黴菌
抗生物素蛋白-過氧化物酶連結(SP)法等,其中SP法是比較常用的方法;聚合物連結,如即用型二步法,此方法尤其適合於內源性生物素含量高的組織抗原檢測。
4、目前幾種常用免疫組化方法簡單介紹
1)免疫螢光方法
是最早建立的免疫組織化學技術。它利用抗原抗體特異性結合的原理,先將已知抗體標上
螢光素,以此作為探針檢查細胞或組織內的相應抗原,在螢光顯微鏡下觀察。當抗原抗體複合物中的螢光素受激發光的照射後即會發出一定波長的螢光,從而可確定組織中某種抗原的定位,進而還可進行定量分析。由於免疫螢光技術特異性強、靈敏度高、快速簡便,所以在臨床病理診斷、檢驗中套用較廣。
2)免疫酶標方法
免疫酶標方法是繼免疫螢光後,於60年代發展起來的技術。基本原理是先以
酶標記的抗體與組織或細胞作用,然後加入酶的底物,生成有色的不溶性產物或具有一定
電子密度的顆粒,通過光鏡或電鏡,對
細胞表面和細胞內的各種抗原成分進行定位研究。
免疫酶標技術是目前最常用的技術。該方法與免疫螢光技術相比的主要優點是:定位準確,對比度好,染色標本可長期保存,適合於光、電鏡研究等。免疫酶標方法的發展非常迅速,已經衍生出了多種標記方法,且隨著方法的不斷改進和創新,其特異性和靈敏度都在不斷提高,使用也越來越方便。目前在病理診斷中廣為使用的有ABC法、SP三步法、即用型二步法檢測系統等。
免疫膠體金技術是以膠體金這樣一種特殊的金屬顆粒作為
標記物。膠體金是指金的
水溶膠,它能迅速而穩定地吸附蛋白,對蛋白的生物學活性則沒有明顯的影響。因此,用
膠體金標記一抗、二抗或其他能
特異性結合免疫球蛋白的分子(如葡萄球菌A蛋白)等作為
探針,就能對組織或細胞內的抗原進行定性、定位,甚至定量研究。由於膠體金有不同大小的顆粒,且膠體金的
電子密度高,所以免疫膠體金技術特別適合於
免疫電鏡的單標記或
多標記定位研究。由於膠體金本身呈淡至深紅色,因此也適合進行光鏡觀察。如套用銀加強的免疫金銀法則更便於光鏡觀察。
5、被檢測的物質
組織或細胞中凡是能作為抗原或半抗原,如蛋白質、
多肽、
胺基酸、多糖、磷脂、
受體、酶、激素、核酸及病原體等都可用相應的
特異性抗體進行檢測。
6、特點
1)特異性強
免疫學的基本原理決定抗原與抗體之間的結合具有高度特異性,因此,免疫組化從理論上講也是組織細胞中抗原的特定顯示,如角蛋白(keratin)顯示上皮成分,
LCA顯示淋巴細胞成分。只有當組織細胞中存在交叉抗原時,才會出現交叉反應。
2)敏感性高
在套用免疫組化的起始階段,由於技術上的限制,只有直接法、間接法等敏感性不高的技術,那時的抗體只能稀釋幾倍、幾十倍;現在由於ABC法或SP三步法的出現,使抗體稀釋上千倍、上萬倍甚至上億倍仍可在組織細胞中與抗原結合,這樣高敏感性的抗體抗原反應,使免疫組化方法越來越方便地套用於常規病理診斷工作。
3)定位準確、形態與功能相結合
該技術通過
抗原抗體反應及呈色反應,可在組織和細胞中進行抗原的準確定位,因而可同時對不同抗原在同一組織或細胞中進行定位觀察,這樣就可以進行形態與功能相結合的研究,對病理學領域開展深入研究是十分有意義的。
7、從蛋白水平檢測角度,免疫組化技術與Western blotting、ELISA的異同
1)Western blotting
蛋白質
免疫印跡,也是利用抗體抗原反應原理,結合化學發光等技術來檢查組織或細胞樣品內蛋白含量的檢測方法。與免疫組化技術相比,定量可能更加準確;當然Western blotting也可定性和定位(通過提取膜蛋白或核蛋白、胞漿蛋白分別檢測其中抗原含量,進而間接反映它們的定位),但敏感性遠遠低於免疫組化技術。
2)ELISA
酶聯免疫吸附試驗,也是利用抗體-抗原-抗原結合反應原理來檢查體液或組織勻漿中蛋白含量的檢測。與免疫組化技術相比,定量最準確,是分泌性蛋白檢測首選方法之一。
下面介紹下免疫組化方法的具體實驗流程步驟。
實驗流程簡介
一、SP三步法
1)石蠟切片,常規脫蠟至水。
2)0.3%或3%H2O2去離子水(無色液體)孵育10-30分鐘,以滅活內源性過氧化物酶活性。
3)蒸餾水沖洗,PBS浸泡5分鐘
4)候選步驟:採用抗原修復:微波(建議30分鐘內4次中火)、高壓、酶修複方法。自然冷卻,再用3分鐘×3次.
5)血清封閉:室溫15-30分鐘,儘可能與二抗來源一致。傾去,勿洗。
6)滴加適當比例稀釋的一抗,37℃孵育2~3小時或4℃過夜(最好復溫)。PBS沖洗,3分鐘×5次。
7)滴加生物素標記的二抗,室溫或37℃孵育30分鐘-1h。
8)PBS沖洗,3分鐘×5次。
9)滴加SP(鏈霉親和素-過氧化物酶),室溫或37℃孵育30分鐘-1h。10)PBS沖洗,3分鐘×5次。
12)自來水充分沖洗。
13)可進行復染,脫水,透明。
14)選擇適當的封片劑封片。
二、即用型二步法
1)脫蠟、水化組織切片。
2)根據所套用的一抗的特殊要求,對組織切片進行預處理。
3)0.3%或3%H2O2去離子水孵育5分鐘-30分鐘,以阻斷內源性過氧化物酶,PBS或TBS沖洗。
4)滴加一抗,室溫或37℃孵育30~60分鐘,或4℃過夜,PBS或TBS浸洗3分鐘×5次。
5)滴加enhangcer增強劑,37℃30min,PBS或TBS浸洗3分鐘×5次。
6)滴加通用型IgG抗體-Fab段-HRP多聚體,室溫/37℃孵育30分鐘-1h,PBS/TBS沖洗,3分鐘×5次。
7)套用DAB溶液顯色。
8)蒸餾水沖洗、復染、脫水、透明、封片。
三、免疫螢光技術(略)
1、酶免疫組化的關鍵環節
1)標本固定
固定的目的是①防止標本從玻片上脫落;
②除去妨礙抗原-抗體結合的類脂,使抗原抗體結合物易於獲得良好的染色結果;
③固定的標本易於保存。固定劑的選擇一般用4%
多聚甲醛,但睪丸組織、眼可能要選用Bouin’s液或mDF液效果較好。
2)脫水、石蠟包埋和製片
脫水用梯度乙醇(由低到高)充分脫水、對組織要完全
浸蠟、切片時刀片要乾淨和鋒利。否則,容易裂片和脫片等。
3)脫蠟和水化
這是為了後面的抗體等試劑能夠充分與組織中抗原等結合反應。脫蠟可以先60℃20min,然後立即
二甲苯1-3分別10min(這個時間是由二甲苯新鮮程度和室溫等綜合決定的),但當天制好的切片一般先60℃3-4h。水化用梯度乙醇(由高到低)。若脫蠟和水化不全易出現局灶性反應和浸洗不全,而產生非特異性背景著色。
4)抗原修復
由於組織中部分抗原在甲醛或
多聚甲醛固定過程中,發生了蛋白之間交聯及
醛基的封閉作用,從而失去抗原性;通過抗原修復,使得細胞內抗原決定族重新暴露,提高抗原
檢測率。常用的修複方法從強到弱一般分為三種,高壓修復、微波修復、胰酶修復。修復液也分為若干種(具體的可以查閱相關資料,大量的:中性的、高pH的等)。我們實驗室一般用微波修復中火6min*4次,效果不錯。注意微波修復後自然冷卻30min左右(只要你覺得修復液的溫度達室溫即可)。
5)細胞通透
目的是使抗體能夠充分地進入胞內進行結合反應。一般用Triton X-100、蛋白酶k等通透液。如Triton X-100可以溶解細胞膜、細胞核膜、
細胞器膜上的脂質而使抗體及大分子結構的物質進入胞漿和胞核內,故在細胞免疫組化時尤為推薦使用,這樣抗體就能順利進入胞內與相應抗原結合。在免疫組織化學(>10um厚切片)和
免疫細胞化學中一般用Triton X-100 作為細胞通透劑,在膜上打孔。同時也是一種去污劑,一般在PBS中加入後終濃度是0.05%即可,而前者終濃度是0.5%-1%。石蠟切片4um左右可以不通透,因為細胞已經被切開了。
6)滅活內源性過氧化物酶和生物素
在傳統的ABC法和SP法中,免疫組化反應結果容易收到內源性過氧化物酶和生物素的干擾,必須用
過氧化氫和
卵白素等進行滅活。滅活內源性POD一般3%過氧化氫滅活時間短點,可以10min左右,而0.3%過氧化氫則可以適當延長封閉時間,一般10~30min;用甲醇配置過氧化氫比
雙蒸水或PBS可能好在保護抗原和固定組織作用,過氧化氫孵育時間過長易引起脫片;現用現配,配好後4℃避光保存。不過,現在已有“第二代即用型免疫組化試劑盒”避免內源性生物素的干擾,推薦使用。
7)血清封閉
組織切片上有剩餘的位點可以與一抗非特異性結合,造成後續結果的假陽性;封閉血清一般是和二抗同一來源的,血清中動物自身的抗體,預先能和組織中有交叉反應的位點發生結合;也可以用小牛血清、BSA、羊血清等,但不能與一抗來源一致。一般室溫10-30min。但也要防止封閉過度
8)一抗和二抗濃度和孵育時間
一抗孵育條件在免疫組化反應中最重要,包括孵育時間、溫度和抗體濃度。一抗孵育溫度有幾種:4℃、室溫、37℃,其中4℃效果最佳;孵育時間:這與溫度、抗體濃度有關,一般37℃1-2h,而4℃過夜和從冰櫃拿出後37℃復溫45min。具體條件還要摸索。
二抗孵育條件:二抗一般室溫或37℃30min-1h,具體時間需要摸索,而濃度一般有工作液,若是濃縮液還要摸索濃度。但在免疫組化中我們一般先把二抗濃度和孵育時間先定下,然後去摸索一抗濃度和孵育時間。建議一抗反應在4℃最佳,反應溫和,但時間最好超過16~24h。
其實許多實驗室抗體稀釋液就用一般PBS即可,但專用的抗體稀釋液中除PBS成份外,還加了
疊氮化鈉防腐劑、BSA穩定劑等組份,對抗體的多次回收利用較好。正因為這種原因,我一直用國產的專用抗體稀釋液,一段時間在更換新抗體稀釋液時實驗結果出現了陰性結果(提示可能一抗沒有結合),最後從抗體濃度和孵育時間、封閉時間等原因排除後,發現是新抗體稀釋液的PH值
偏酸,而使
抗原抗體反應不佳,終而出現假陰性結果。
10)切片清洗(浸洗、沖洗和漂洗)
為了防止一抗、二抗等試劑殘留而引起非特異性染色,所以適當地加強清洗(延長時間和增多次數)尤為重要,我一般在一抗孵育前的清洗是3min*3次,而一抗孵育後的清洗均為5次*5min。
注意:①單獨沖洗,防止交叉反應造成污染。
②溫柔沖洗,防止切片的脫落。我喜歡用浸洗方式;
③沖洗的時間要足夠,才能徹底洗去結合的物質。
④PBS的PH和離子強度的使用和要求。這方面我有慘痛教訓,當時我買的抗體稀釋液
偏酸,結果背景一片黃(未見特異性染色),建議PH在7.4-7.6濃度是0.01M。(中性及弱鹼性條件(PH7-8)有利於免疫複合物的形成,而酸性條件則有利於分解;低離子強度有利於免疫複合物的形成,而高離子強度則有利於分解)
11)DAB顯色
背景的深淺和特異性染色的深淺均可以由DAB孵育條件決定。DAB顯色時間不是固定的,主要由顯微鏡下控制顯色時間,到出現特異性染色較強而本底著色較淺時即可沖洗;DAB顯色時間很短(如幾秒或幾十秒)就出現很深的棕褐色,這很可能說明你的抗體濃度過高或抗體孵育時間過長,需要下調抗體濃度或縮短你的抗體孵育時間;此外,若很短時間就出現背景很深,還有可能你前面的封閉非特異性蛋白不全,需要延長封閉時間;DAB顯色時間很長(如超過十幾分鐘)才出現陽性染色,一方面可能說明你的抗體濃度過低或孵育時間過短(最好一抗4℃過夜);另一方面就是封閉時間過長。
12)復染
目的是形成細胞輪廓,從而更好地對目標蛋白進行定位,經常用
蘇木素復染(胞核染料)。注意蘇木素復染時間要看當時的室溫、溶液的新舊、目標抗原的定位等情況,一般數秒-數分鐘,胞漿蛋白可以適當時間長一點,而胞核蛋白則要短。不過這個如果染色不理想可以補救的。方法是:染色深則分化時間稍長些即可;染色淺則再置於蘇木素中染色即可。鹽酸酒精是分化,氨水是返蘭。作用不同。片子復染完後流水振洗,然後置於鹽酸酒精中數秒(一定動作要快)後拿出流水振洗,在放入氨水中返蘭即可。
13)封片
為了長期保存,我們一般用中性樹膠等封片,避免產生氣泡,方法是直接在
載玻片組織上滴一滴封片液,然後一手拿住蓋片某一拐角,而另一手拿對面的那個拐角,接近封片液近端的拐角先降低,直至接觸到液體時為止;當發現液體接觸面在不斷彌散時,則可以緩慢降低另一拐角,這樣一般不會產生氣泡。
2、免疫螢光方法中的重要環節
1)冰凍切片製備
建議用新鮮組織,否則組織細胞內部結構破壞,易使抗原彌散。選用乾淨鋒利的刀片、組織一定要冷凍適度等,防止裂片和脫片嚴重。
2)組織切片固定
切好片風乾後立即用冰
丙酮等
固定液進行固定5-10min,尤其要較長時間保存的白片,一定要及時固定和適當保存。
3)血清封閉
為防止內源性非特異性蛋白抗原的結合,需要在一抗孵育前先用血清(與二抗來源一致)封閉,減弱背景著色。血清封閉的時間是可以調整的,一般10-30min。
4)一抗孵育條件
在免疫組化反應中最重要,包括孵育時間和抗體濃度。一抗孵育溫度有幾種:4℃、室溫、37℃,其中4℃效果最佳;孵育時間:這與溫度、抗體濃度有關,一般37℃1-2h,而4℃過夜和從冰櫃拿出後37℃復溫45min。具體條件還要摸索。
5)二抗孵育條件
二抗一般室溫或37℃30min-1h,具體時間需要摸索,而濃度一般有工作液,若是濃縮液還要摸索濃度,切記要避
光反應。但在免疫螢光中我們一般先把二抗濃度和孵育時間先定下,然後去摸索一抗濃度和孵育時間。最後,
螢光素標記的二抗隨著保存時間的延長,可能後有大量的游離螢光素殘留,需要注意配製時小包裝和並進行適當的離心。
6)復染
目的是形成細胞輪廓,從而更好對目標蛋白進行定位。一般常用DAPI復染。
7)封片
為了長期保存,我們一般用緩衝甘油等封片,此外還有專門的抗螢光萃滅封片液。避免產生氣泡,方法是直接在載玻片組織上滴一滴封片液,然後一手拿住蓋片某一拐角,而另一手拿對面的那個拐角,接近封片液近端的拐角先降低,直至接觸到液體時為止;當發現液體接觸面在不斷彌散時,則可以緩慢降低另一拐角,這樣一般不會產生氣泡。
8)切片清洗
為了防止一抗、二抗等試劑殘留而引起非特異性染色,所以適當地加強清洗(延長時間和增多次數)尤為重要,我一般在一抗孵育前的清洗是3min*3次,而一抗孵育後的清洗均為5次*5min。
注意:
⑴單獨沖洗,防止交叉反應造成污染。
⑵溫柔沖洗,防止切片的脫落。我喜歡用浸洗方式;
⑶沖洗的時間要足夠,才能徹底洗去結合的物質。
⑷PBS的PH和離子強度的使用和要求。這方面我有慘痛教訓,當時我買的抗體稀釋液偏酸,結果背景一片黃(未見特異性染色),建議pH在7.4-7.6濃度是0.01M。(中性及弱鹼性條件(pH7-8)有利於免疫複合物的形成,而酸性條件則有利於分解;低離子強度有利於免疫複合物的形成,而高離子強度則有利於分解)
9)拍照
有條件的話最好立即拍照,若不能及時拍照,也要封好片和用指甲油封固,保持避光和濕度。使用螢光顯微鏡注意嚴格按照螢光顯微鏡出廠說明書要求進行操作,不要隨意改變程式;應在暗室中進行檢查;防止紫外線對眼睛的損害,在調整光源時應戴上防護眼鏡;檢查時間每次以1~2h為宜,超過90min,超高壓汞燈發光強度逐漸下降,螢光減弱;標本受紫外線照射3~5min後,螢光也明顯減弱或褪色;激發光長時間的照射,會發生螢光的衰減和
淬滅現象;所以最多不得超過2~3h;螢光顯微鏡光源壽命有限,標本應集中檢查,以節省時間,保護光源。天熱時,應加電扇散熱降溫,新換燈泡應從開始就記錄使用時間。燈熄滅後欲再啟用時,須待燈光充分冷卻後才能點燃。一天中應避免數次點燃光源。關閉汞燈至少在開啟15-30分鐘後;標本染色後立即觀察,因時間久了螢光會逐漸減弱。若將標本放在聚乙烯塑膠袋中4℃保存,可延緩螢光減弱時間,防止封裱劑蒸發;使用的玻片等載體,都必須厚度均勻,無明顯的自發螢光,如果使用油鏡,還必須保證鏡油為無螢光鏡油;電源最好裝穩壓器,否則電壓不穩不僅會降低汞燈的壽命,也會影響鏡檢的效果。
3、免疫組化和免疫螢光結果分析:見第一場試驗講座。
案例一 DAB染色後切片著色一片黃/背景深
背景:奧運會期間我們課題組研究生都在實驗室做實驗,許多從北京購買的試劑買不到,對我們的許多實驗產生了很大的影響。我以前一直用中杉金橋的SP三步法染色試劑盒,效果不錯,在奧運會期間我準備做同批實驗分不同批次酶免疫組化實驗,第一批組化實驗結果很好,抗體濃度感覺比較合適(Santa Cruz公司1:200),等做第二批時發現封閉血清不夠了,為了保證實驗順利進行,我又從福州邁新頂了一個SP試劑盒,同時抗體
稀釋液也不夠了,我又重新從博士德公司買了一小瓶10ml。從第二批實驗開始,組化實驗結果一直顯示強背景著色,
特異性染色很難辨別。後來我將標本拿到上海舜田生物去做,做了效果很不錯,於是我就請教了他們公司從事病理30多年經驗的老師,她告訴我應該如何去分析和解決問題,很快我就找到了思路,結果問題終於解決了。
問題及其解答:產生組織切片非特異性染色的原因有哪些?如何解決?
1、抗體孵育時間過長、抗體濃度高易增加背景著色。這可通過縮短一抗/二抗孵育時間、稀釋抗體來控制。這是最重要的一條。
2、一抗用多克隆抗體易出現非特異性著色,建議試用
單克隆抗體看看。
3、內源性過氧化物酶和生物素在肝臟、腎臟等組織含量很高(含血細胞多的組織),需要通過延長滅活時間和增加滅活劑濃度來降低背景染色;
4、非特異性組分與抗體結合,這需要通過延長二抗來源的動物免疫血清封閉時間和適當增加濃度來加強封閉效果;
5、 DAB孵育時間過長或濃度過高;
6、 PBS沖洗不充分,殘留抗體結果增強著色,在一抗/二抗/SP孵育後的浸洗尤為重要;
7、標本染色過程中經常出現乾片,這容易增強非特異性著色。
我的實際解決方案:以上的分析可能對於初學者還是不容易的,下面我就把我的排除實驗的具體過程與大家進行分享、交流和討論。
1、首先排除抗體孵育條件。一般來說,著色效果的好壞與抗體的孵育條件是密不可分的,由於用SP法已經做出來過一次且效果不錯,因此對於同樣組織的同一抗原進行分析,這種因素可以先排除。
2、其次,DAB孵育時間是否太長?做出來那一次我是孵育8min,後來也是8-10min,我單獨做了一次實驗來排除該因素。結果孵育2、5min時先出現背景,而特異性染色較淺,故這不符合常理,一般先出現特異性染色,然後隨著時間的延長,會出現非特異性背景著色。
3、最後,血清封閉的問題?以前我一般孵育15-30min,所以我單獨做了一次實驗用血清封閉室溫1h,其它條件同做出來的那一次,結果也一樣背景著色很深。
4、此外,我在改進的同時,也對PBS清洗不斷地延長時間和增加次數,甚至完全參照
試劑盒說明書來進行操作(我以前一般一抗4℃過夜且室溫復溫45min、二抗37℃30min、SP反應37℃ 30min),以及過氧化氫滅活加強等等均未起到效果。我冷靜地分析了一下整個實驗流程,與第一次做出來相比,只有兩個地方做了改動:因血清不夠而更換了不同廠家試劑盒、因抗體
稀釋液用完而重新買了抗體稀釋液。
5、我用PBS替代一抗稀釋液(我以前還回收抗體,自我覺得抗體稀釋液中含防腐劑和蛋白穩定劑),其它步驟和組織切片完全與第一次做出來的一致(包括血清也是老試劑盒內剩餘的一點),奇蹟出現了:結果很好。因為抗原抗體反應除溫度、抗原/抗體濃度外,然後就是pH值,於是我測了新抗體稀釋液、老抗體稀釋液和PBS的pH值,結果是前者偏酸性(<6、0),而後兩者均在7、5左右。
6、看來主要禍根是抗體稀釋液的pH值出問題了,於是我又用PBS替代抗體稀釋液和新試劑盒內的試劑對組織切片做了免疫組化,結果還是沒有做出來:背景很深。這真把我搞慘了。難道還有什麼原因嗎?通過仔細分析:一抗一定是結合上去了(老SP試劑盒結果很好),問題是二抗沒有結合上去也不對(因為最後背景很深,這說明二抗可能也結合上去了),DAB孵育時間現在只用1、5min也是背景深而特異性染色淺,那我又懷疑封閉血清了。
7、我做了兩張切片:一張用老試劑盒內還剩下一點的血清而另一張用新試劑盒內的封閉血清,其餘試劑(二抗、SP)均用新試劑盒提供的,結果是前一張效果很好,而後一張能夠看到特異性染色,但背景太深,拍照效果不佳。看來封閉血清也是罪會禍首之一。結果分析顯示:抗體
稀釋液的PH值偏低和封閉血清的失效導致了我的免疫組化結果的不佳,望大家在以後的組化實驗中也要注意這兩個不太引人注意的關鍵問題。慘痛的教訓,值得引以為鑑。
案例二DAB染色後切片著色呈陰性結果
背景:其實免疫組化在DAB染色後一般有四種情況:陽性染色效果很好、陰性染色、非特異性染色很深、陰陽臉(染色不均勻)。而陰性染色是許多初學者經常遇到的頭疼問題。我身邊有個研究生同學在我們實驗室初次涉入免疫組化,聽說步驟不難,跟我後面做了幾次之後,就自己開始做了,連續做了三次,結果均是陰性染色。很掃興,不知是什麼原因導致的,後來我還是請教了上海舜田生物老師,她免費提供給我我很大的幫助,解決問題的思路也逐步清晰。
問題及其解答:免疫組化染色呈陰性結果的原因有哪些?
1、抗體濃度和質量問題以及抗體來源選擇錯誤。不知抗體是進口的還是國產的工作液,怎么這么高
稀釋度也沒能做出陽性結果?另外,不是抗體濃度越高就越易出現陽性結果,抗原抗體反應有前帶和後帶效應,必須摸索最佳濃度。
2、抗原修復不全,對於甲醛固定的組織必須用充分抗原修復來打開抗原表位,以利於與抗體結合;建議微波修復用高火4次*6min試試。有人做過實驗,這是最佳的時間和次數。若不行,還可高壓修復。
3、組織切片本身這種抗原含量低;
4、血清封閉時間過長。
5、DAB孵育時間過短。
6、細胞通透不全,抗體未能充分進入胞內參與反應。
7、開始做免疫組化,我建議你一定要首先做個陽性對照片,排除抗體等外的方法問題。
我的實際解決方案:
1、首先,排除組織切片內的抗原有無丟失及其含量多少。免疫組化中兩個最重要的因素是抗原和抗體。
⑴抗原有無丟失主要看組織切片的新鮮程度,一般切片室溫保存超過3-6個月,可能切片內的抗原丟失很嚴重(有文獻支持),此時可以通過重新用石蠟塊切片來進一步驗證(蠟塊需要低溫保存)。
⑵石蠟切片在製作過程中可能因醛基對抗原決定族的封閉,這需要通過抗原修復來充分暴露,從而增加抗原抗體結合反應,提高陽性率,我一般用6min*4次中火微波抗原修復,用枸櫞酸鈉緩衝液。
⑶組織切片中本身抗原含量的多少?這方面我有教訓的,我做胎鼠睪丸間質細胞鑑定,用1:200一抗效果很好;但我用1:200一抗孵育成年睪丸間質細胞檢測,幾乎呈陰性,後來證實是因為兩者抗原含量相差甚遠,則一抗也要適當提高濃度。
2、其次,檢查抗體有無選擇錯誤和抗體孵育條件是否不適。
⑴一抗選擇單克隆抗體易出現陰性結果,因為靈敏度低但
特異性好;一抗的species reactivity中無檢測組織的種屬,這是比較常見的錯誤;一抗選擇rat,而二抗是抗mouse/rabbit等均有可能出現陰性結果。
⑵抗體孵育時間過短,容易導致陰性結果。一般一抗我建議4℃孵育過夜和37℃復溫45min;二抗我一般37℃30min。我不喜歡參照二抗染色試劑盒說明書。
⑶抗體濃度過低。這是陰性結果的最可能原因。必須提高
稀釋度,我一般初次做一種新抗體,喜歡先用說明書建議的低濃度和高濃度做一次,然後決定是向高還是低方向摸索。一般先決定二抗的濃度(工作液就好辦了,直接滴加),重點摸索一抗的最適濃度。注意:免疫反應中存在前帶和後帶效應,這提示不是濃度越高,陽性率就越高,反之亦然。
⑷重要原因排除之後,也不要忽視抗體的質量:原裝抗體一般比較穩定,效果較好;而進口分裝次之;工作液可能要注意質量問題。
3、同時,DAB的孵育時間可能要適當延長,在鏡下觀察,有時可延長至30min。但一般3-10min最好,此時背景也較淺。否則,說明抗體濃度不合適。
4、最後,血清封閉時間也可相應縮短。一般10-30min,但這個時間可以調整,封閉主要是降低切片的總體背景著色。
5、此外,細胞通透也不可忽視。許多戰友認為石蠟切片一般不需細胞通透,因為切片時可能已經把細胞切開了,但對於胞核蛋白,建議還是通透一下,促進抗體等試劑充分進入參與反應。
6、以上原因,都是針對實際中常見原因來進行分析的,前提是排除操作者的操作錯誤而引起陰性結果,這就需要新手還是要設定陽性對照以排除方法的問題。還有抗體
稀釋液的pH值過低等其它原因的干擾。總之,要想把免疫組化做好,可能每一個環節都很重要,但也存在主次之分,出現問題了,需要通過先排除主要的,再依次排除次要的--這是衡量你對免疫組化原理掌握與否的關鍵所在。
案例三石蠟切片免疫螢光染色呈陰性結果或非特異性結果
背景:因實驗需要,於2008年07月04日初次做肝臟組織ZO-1(一種胞膜蛋白,
緊密連線蛋白)免疫螢光染色,以前我對酶免疫組化非常熟悉,在丁香園子內也有不少置頂貼和精華帖,但免疫螢光一直還沒做過(原理知道,但細節不太了解)。我先用石蠟切片做了5次,結果一直不理想(表現為未見特異性強染色);近幾日,在舜田生物老師的幫助下,我又切了冰凍切片,做了2次,終於基本成功了。在這個過程中,我對免疫螢光染色技術有了全新的認識,而前些天發出免疫螢光求助貼,回復的很少,所以有必要加強對免疫螢光方面的討論),不妥之處敬請指正。有人會問酶免疫組化做的好好的,為何要做免疫螢光?其實,這也是我以前思考的難題,現在我認為可能胞膜蛋白含量不高,用普通免疫免疫組化可能做不出來,需要敏感的免疫螢光方法來進行蛋白檢測(我是看許多外文文獻都是這樣做的,因此選擇免疫螢光染色。)
問題及其解答:如何降低非特異性螢光染色和避免陰性著色?
1、非特異性染色產生原因及其解決方案:
⑴游離
螢光素殘留在二抗中。一部分螢光素未與蛋白質結合,形成了聚合物和衍化物,而不能被透析除去。二抗配置時用透析法或層析法分離螢光素標記的二抗和游離的二抗。購買高質量、高純度的螢光素二抗。
⑵抗體以外的血清蛋白與螢光素結合形成螢光素脲蛋白,可與組織成分結合。
⑶組織抗原封閉不全。除去檢查的抗原以外,組織中還可能存在類屬抗原(如Forssman氏抗原),可與組織中特異性抗原以外之之相應抗體結合。延長血清封閉時間。
⑷從組織中難於提純抗原性物質,所以製備的免疫血清中往往混雜一些抗其他組織成分的抗體,以致容易混淆。
⑸抗體分子上標記的
螢光素分子太多,這種過量標記的抗體分子帶過多的陰離子,可吸附於正常組織上而呈現非特異性染色。
⑹螢光素不純、標本固定不當等。
⑺一抗和二抗孵育條件和濃度不合適。調整一抗和二抗孵育條件和濃度至最佳。
⑻一抗和二抗孵育後的清洗不充分。增加清洗次數和延長清洗時間。
2、陰性染色產生的原因有:
⑴一抗和二抗濃度不合適或孵育條件不妥。
⑵
螢光素提前衰退。螢光素質量不佳或操作過程中沒有注意避光等防止螢光素衰退的事項。
⑶血清封閉時間過長。
⑸組織切片不平、裂片或脫片很嚴重,易引起大塊陰性著色。
⑹組織標本不新鮮或已經冷凍組織製成的切片中抗原易彌散,易引起本來表達的部位陰性染色或弱著色。
⑺螢光顯微鏡不會使用,激發波長選擇錯誤。
 免疫組化染色(IHC)
免疫組化染色(IHC)
 免疫組化染色(IHC)
免疫組化染色(IHC)
