基本介紹
- 中文名:節流膨脹過程
- 外文名:Throttling Expansion
- 領域:熱力學
- 對象:氣體或液體等流體
- 條件:高壓向低壓絕熱膨脹
- 定理:熱力學第一定律
簡介
節流膨脹原理
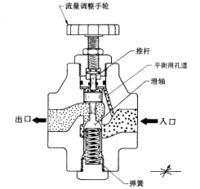 節流閥
節流閥焦耳-湯姆遜係數
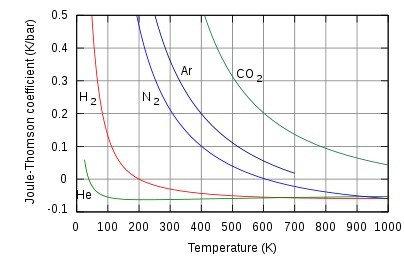 不同氣體在大氣壓下的焦耳湯姆遜係數
不同氣體在大氣壓下的焦耳湯姆遜係數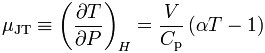
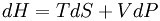
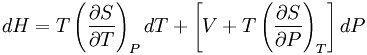
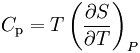
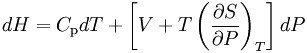
絕熱膨脹
絕熱過程


 節流閥
節流閥 不同氣體在大氣壓下的焦耳湯姆遜係數
不同氣體在大氣壓下的焦耳湯姆遜係數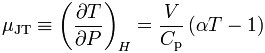
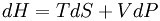
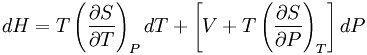
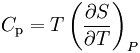
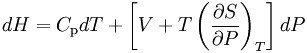


節流膨脹過程(Throttling Expansion Process)是指在較高壓力下的流體(氣或液)經多孔塞(或節流閥)向較低壓力方向絕熱膨脹過程。熱膨脹是指與外界沒有熱量交換,但...
節流膨脹()較高壓力下的流體(氣或液)經多孔塞(或節流閥)向較低壓力方向絕熱膨脹過程。...
節流過程是指流體流動時由於通道截面突然縮小(如孔板、閥門等)而使壓力降低的熱力過程。...
管道中流動的流體經過通道截面突然縮小的閥門、狹縫及孔口等部分後發生壓力降低的現象稱為節流。工程上常用節流過程控制流體的壓力,還可利用節流時壓力降低與流量的...
式中μ稱焦耳-湯姆生係數,或稱節流膨脹係數。由於膨脹過程dP總是負值,所以P值為正時dT應與dP同號,即dT為負值,這就表示節流引起了致冷效應,與此相反,μ值為...
J-T閥就是焦耳-湯姆遜節流膨脹閥,利用焦耳-湯姆遜節流膨脹原理設計的節流閥門。簡單的說通過節流減壓使加壓氣體膨脹而產生低溫。...
實際的膨脹機膨脹會有損失,也是不可逆過程,熵也增大。但是,它的不可逆程度比節流過程小,增加的熵值也小。因此,熵的增加值反映了這個絕熱過程不可逆程度的大小。...
焦耳-湯姆孫效應是氣體在節流過程中溫度隨壓強而變化的現象。氣體通過多孔塞或節流閥膨脹的過程稱為絕熱節流膨脹。絕熱節流過程是不可逆過程。由於過程在絕熱系統...
5.2.1節流膨脹過程5.2.2做外功的等熵膨脹過程5.3製冷裝置循環5.3.1蒸汽壓縮製冷循環5.3.2製冷劑的選擇5.3.3載冷劑的選用...
8.1.1 壓縮過程的熱力學分析8.1.2 多級壓縮8.2 膨脹過程8.2.1 節流膨脹8.2.2 絕熱做功膨脹8.3 蒸汽動力循環8.3.1 Rankine循環及其熱效率...
氣氨冷凝為液氨,是靠冷凍循環來完成的,冷凍循環主要由壓縮,冷卻冷凝,節流膨脹,蒸發四個過程組成。氣氨經冰機壓縮提壓後,進入冷凝器,由冷卻水把氣氨冷凝為液氨,...
機對外作功使之冷卻的方法以提高空氣液化的效率,其基 本液化過程’,林德液化裝置相似,仍為經冷卻後的空氣節 流膨脹,如圖所不空氣1經壓縮機壓縮後在水冷器中冷 ...
1.8節流膨脹——實際氣體的U和H1.8.1節流過程1.8.2焦耳—湯姆遜係數與實際氣體的U和H1.8.3制冷機和熱泵的工作原理基本要求習題第二章熱力學第二定律...
