定義,物理性質,微觀結構,化學式,物理性質,氣味,物態,沸點,熔點,密度,溶解度,化學性質,鹵化反應,熱裂反應,氧化反應和燃燒,硝化反應,磺化及氯磺化,製備,命名規則,普通命名法,系統命名法,
定義
只由碳氫兩種元素組成的化合物稱為碳氫化合物,簡稱為
烴。根據烴分子骨架的不同,烴可分為鏈烴(
脂肪烴)和環烴(
脂環烴)兩大類。鏈烴又可以分為飽和烴和不飽和烴。整體構造大多僅由碳
氫原子以碳碳單鍵與碳氫單鍵組成的有機化合物,飽和意味著分子中的碳原子和其他原子的結合達到了最大限度。
嚴格說來烷烴並不包括
環烷烴,故本詞條著重闡釋不含環狀的烷烴。
此外,烷烴是飽和烴的一種,飽和烴包括了環烷烴以及烷烴。
物理性質
1.當碳原子數小於或等於4時,烷烴在常溫下呈氣態,其他的烷烴常溫下呈固態或液態(新戊烷常溫下為氣態)
2.都不溶於水,易溶於有機溶劑。
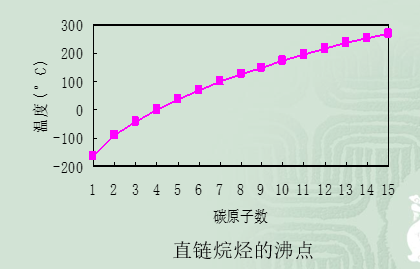
3.隨碳原子數的增加沸點逐漸升高。
4.隨碳原子數的增加,相對密度逐漸增大。烷烴的密度一般小於水的密度。
微觀結構
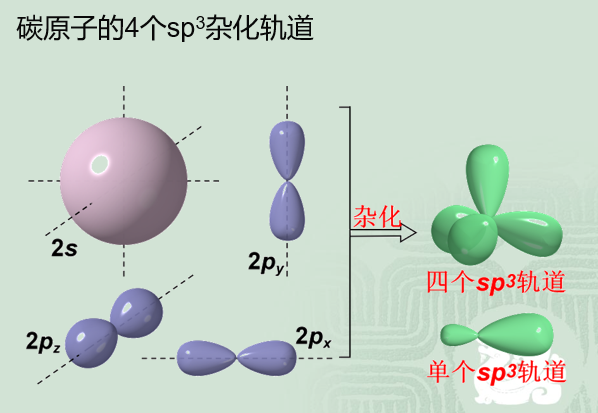
烷烴並非是結構式所畫的平面結構,而是立體形狀的,所有的碳原子都是sp
3雜化,各原子之間都以σ鍵相連,鍵角接近109°28‘,C-C鍵的平均鍵長為154 pm,C-H鍵的平均鍵長為109 pm,由於σ鍵電子云沿鍵軸呈軸對稱分布,兩個成鍵原子可繞鍵軸“自由”轉動。
化學式
從甲烷開始,每增加一個碳原子就相應地增加兩個氫原子,因此烷烴的通式為C
nH
2n+2,n表示碳原子的數目(n=1,2,3,···),理論上n可以很大,但已知的烷烴n大約在100以內。擁有相同分子通式和結構特徵的一系列化合物稱為
同系列,烷烴同系差為CH
2,C原子個數不同的烷烴互為同系物。同系列中的同系物的結構相似,化學性質相近,物理性質隨著碳原子的增加而呈現規律性變化。
物理性質
氣味
低
沸點(boiling point)的烷烴為無色液體,有特殊氣味;高沸點烷烴為黏稠油狀液體,無味。
物態
烷烴的物理性質隨分子中碳原子數的增加,呈現規律性的變化。
在室溫25°下,含有1~4個碳原子的烷烴為氣體。
含有5~17個碳原子的烷烴為液體。但實際上含有10~19個碳原子的烷烴正常溫度下可以為固體。
含有18個碳原子以上的正烷烴為固體,但直至含有60個碳原子的正烷烴(熔點99℃)後的
熔點(melting point)都不超過100℃。烷烴為
非極性分子(non-polar molecule),
偶極矩(dipole moment)為零,但分子中電荷的分配不是很均勻的,在運動中可以產生瞬時偶極矩,瞬時偶極矩間有相互作用力(
色散力)。此外分子間還有
范德華力,這些分子間的作用力比化學鍵的小一二個數量級,克服這些作用力所需能量也較低,因此一般有機化合物的熔點、沸點很少超過300℃。
沸點
正烷烴的沸點隨碳原子的增多的而升高,這是因為分子運動所需的能量增大,分子間的接觸面增大,范德華力隨之增強。低級烷烴每增加一個CH
2,
相對分子質量變化較大,沸點也相差較大;高級烷烴沸點差距逐漸減小。故低級烷烴比較容易分離,高級烷烴分離困難得多。
在
同分異構體中,分子結構不同,分子接觸面積不同,相互作用力也不同。正戊烷沸點36.1℃,2-甲基丁烷沸點25℃,2,2-二甲基丙烷沸點只有9℃。叉鏈分子趨於球形,由於支鏈的位阻作用,使其接觸面積減少,從而減少了分子間作用力,沸點較低。
熔點
固體分子的熔點也隨碳原子的增多增加而增高,但不像沸點變化那樣有規律,同系列C
1-C
3不那么規則,但C
4以上的是隨著碳原子數的增加而升高。這是由於晶體分子間的作用力,不僅取決於相對分子質量大小,還與分子在
晶格中的排列有關。分子對稱性高,排列比較整齊就越緊密,分子間吸引力大,熔點就越高。在正烷烴中,含奇數碳原子的烷烴其熔點升高較含偶數碳原子的少。以至在直鏈烷烴的熔點曲線中,含奇數和含偶數的碳原子的烷烴各構成一條熔點曲線,偶數在上,奇數在下。
通過
X射線衍射方法分析,固體正烷烴晶體為
鋸齒形,在奇數碳原子齒狀鏈中兩端甲基同處在一邊,如
正戊烷。偶數碳鏈中兩端甲基不在同一邊,如正己烷,偶數碳鏈彼此更為靠近,相互作用力大,故熔點升高值較單數碳鏈升髙值較大一些。
密度
烷烴的密度(density)隨相對分子質量增大而增大,這也是分子間相互作用力的結果,分子間引力增大,分子間的距離相應減小,相對密度則增大,密度增加到一定數值後,相對分子質量增加而密度變化很小。最大接近於0.8 g·cm-3左右,所以所有的烷烴都比水輕。
溶解度
烷烴中的
σ鍵極性很小,且其分子偶極矩為零,是非極性分子。根據相似相溶原則, 烷烴可溶於非極性溶劑如
四氯化碳、烴類化合物(
乙醚、
苯)中,不溶於
極性溶劑,如水中。
與碳原子數相等的鏈烷烴相比,環烷烴的沸點、熔點和密度均要髙一些。這是因為鏈形化合物可以比較自由地搖動,分子間“拉”得不緊,容易揮發,所以沸點低一些。由於這種搖動,比較難以在晶格內做有次序的排列,所以熔點也低一些。由於沒有環的牽制,鏈形化合物的排列也較環形化合物鬆散些,所以密度也低一些。
同分異構體和
順反異構體也具有不同的物理性質。下表是若干烷烴和環烷烴的物理常數。
名稱
| 分子式
| 沸點/℃
| 熔點/℃
| 相對密度
|
|---|
| CH4
| -161.7
| -182.6
| ——
|
| C2H6
| -88.6
| -182.8
| ——
|
| C3H8(C3H6)
| -42.2(-32.7)
| -187.1(-127.6)
| 0.5005
|
| C4H10(C4H8)
| -0.5(12.5)
| -138.4(-80)
| 0.5788
|
| C5H12(C5H10)
| 36.1(49.3)
| -129.3(-93.9)
| 0.6264(0.7457)
|
| C6H14(C6H12)
| 68.7(80.7)
| -94.0(6.6)
| 0.6594(0.7786)
|
| C7H16(C7H14)
| 98.4(118.5)
| -90.5(-12.0)
| 0.6837(0.8098)
|
| C8H18(C8H16)
| 125.6(150)
| -56.8(14.3)
| 0.7028(0.8349)
|
| C9H20
| 150.7
| -53.7
| 0.7179
|
| C10H22
| 174.0
| -29.7
| 0.7298
|
| C11H24
| 195.8
| -25.6
| 0.7404
|
| C12H26
| 216.3
| -9.6
| 0.7493
|
| C13H28
| 245.4
| -6
| 0.7568
|
| C14H30
| 251
| 5.5
| 0.7636
|
| C15H32
| 268
| 10
| 0.7688
|
| C16H34
| 280
| 18.1
| 0.7749
|
| C17H36
| 303
| 22.0
| 0.7767
|
| C18H38
| 308
| 28.0
| 0.7767
|
| C19H40
| 330
| 32.0
| 0.7776
|
| C20H42
| 343
| 36.4
| 0.7886
|
| C30H62
| 449.7
| 66
| 0.7750
|
| C40H82
| ——
| 81
| ——
|
化學性質
由於烷烴中只含有C-C單鍵和C-H單鍵,這兩種鍵的強度都很大,而且碳和氫的電負性相差很小,所以C-H鍵極性很小,屬於弱極性鍵,因此相對於其他有機物來說,烷烴離子型試劑有相當大的化學穩定性,在一般情況下,烷烴與大多數試劑如強酸、強鹼、強氧化劑等都不起反應。但在一定條件下,如在高溫或有催化劑存在是,烷烴也可以和一些試劑作用。
鹵化反應
烷烴中的氫原子被鹵原子(即第七主族元素)取代的反應稱為
鹵化反應(halogenation)。。但有實用意義的鹵化反應是
氯化和
溴化。
1.氯化
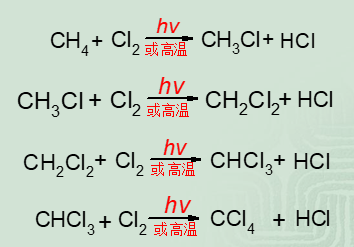
烷烴於室溫並且在黑暗中與氯氣不反應,但在日光或紫外光照射或在高溫(250~400℃)作用下,能發生取代反應,烷烴分子中的氫原子能逐步被氯取代,得到不同的氯代烷的混合物。
例如甲烷與氯發生氯代反應生成四種氯代產物的混合物。其中hv表示光照
如果控制氯的用量,用大量甲烷,主要得到氯甲烷;如用大量氯氣,主要得到四氯化碳。工業上通過精餾,使混合物一一分開。以上幾個氯化產物,均是重要的溶劑與試劑。
甲烷氯化反應的事實是:
①在室溫暗處不發生反應;
②髙於250℃發生反應;
③在室溫有光作用下能發生反應;
④用光引發反應,吸收一個光子就能產生幾千個氯甲烷分子;
⑤如有氧或有一些能捕捉自由基的雜質存在,反應有一個誘導期,誘導期時間長短與存在這些雜質多少有關。根據上述事實的特點可以判斷,甲烷的氯化是一個自由基型的取代反應。
2.甲烷的鹵化
在同類型反應中,可以通過比較決定反應速率一步的活化能大小,了解反應進行的難易。
氟與甲烷反應是大量放熱的,但仍需+4.2 KJ/mol活化能,一旦發生反應,大量的熱難以移走,破壞生成的氟甲烷,而得到碳與氟化氫,因此直接氟化的反應難以實現。碘與甲烷反應,需要大於141 KJ/mol的活化能,反應難以進行。氯化只需活化能+16.7 KJ/mol,溴化只需活化能+75.3 KJ/mol,故鹵化反應主要是氯化、溴化。氯化反應比溴化易於進行。
碘不能與甲烷發生取代反應生成碘甲烷,但其逆反應很容易進行。
由基鏈反應中加入碘,它可以使反應中止。
3.高級烷烴的鹵化
在紫外光或熱(250~400℃)作用下,氯、溴能與烷烴發生反應,氟可在惰性氣體稀釋下進行烷烴的氟化,而碘不能。
自由基反應
1.碳自由基的定義和結構
某一鍵均裂時會產生帶有孤電子的原子或基團,稱之為自由基。孤電子在氫原子上的自由基稱為氫自由基。孤電子在碳原子上的自由基稱為碳自由基。烷烴中的碳氫鍵均裂時會產生一個氫自由基和一個烷基自由基即碳自由基。自由基碳sp2雜化,三個sp2雜化軌道具有平面 三角形的結構,每個sp2雜化軌道與其它原子的軌道通過軸向重疊形成σ鍵,成鍵軌道上有一對自旋相反的電子。一個p軌道垂直於此平面,p軌道被一個孤電子占據。
2.鍵解離能和碳自由基的穩定性
(1)鍵解離能
分子中的原子總是圍繞著它們的平衡位置做微小的振動,分子振動類似於彈簧連線的小球的運動,室溫時,分子處於基態,這時振幅很小,分子吸收能量,振幅增大。如果吸收了足夠的能量,振幅增大到一定程度,鍵就斷了,這時吸收的熱量,是鍵解離反應的焓(ΔH),是這個鍵的鍵 能,或稱鍵解離能(bond-dissociation energy),用Ed表示。
(2)碳自由基的穩定性
自由基的穩定性,是指與它的母體化合物的穩定性相比較,比母體化合物能量高得多的較不穩定,高得少的較穩定。從上面C一H鍵的解離能數據可以看出:CH4中C—H鍵解離,其解離能最大,在同列系中第一個化合物往往是比較特殊的;CH3CH3與CH3CH2CH3中斷裂一級碳上的氫,解離能較CH4稍低,形成的均為一級自由基;CH3CH2CH3中斷裂二級碳原子上的氫, 其解離能又低一些,形成二級自由基;(CH3)3CH中三級碳原子上的氫斷裂,其解離能最低,形成三級自由基。這些鍵解離反應中,產物之一是,均是相同的,因此鍵解離能的不同,是反映了碳自由基的穩定性不同。解離能越低的碳自由基越穩定。因此碳自由基的穩定性順序為
3°C·>2°C·>1°C·>H3C·
在烷烴分子中,C—C鍵也可解離。
3.自由基反應的共性
化學鍵均裂產生自由基。由自由基引發的反應稱為自由基反應,或稱自由基型的鏈反應(chain reaction)。自由基反應一般都經過鏈引發(initiation )、鏈轉移(propagation,或稱鏈生成)、鏈終止(termirrntimi)三個階段。鏈引發階段是產生自由基的階段。由於鍵的均裂需要能量,所以鏈引發階段需要加熱或光照。
有些化合物十分活潑,極易產生活性質點自由基,這些化合物稱之為引發劑(initiator)。有時也可以通過單電子轉移的氧化還原反應來產生自由基。鏈轉移階段是由一個自由基轉變成另一個自由基的階段,猶如接力賽一樣,自由基不斷地傳遞下去,像一環接一環的鏈,所以稱之為鏈反應。鏈終止階段是消失自由基的階段。自由基兩兩結合成鍵。所有的自由基都消失了,自由基反應也就終止了。
自由基反應的特點是沒有明顯的溶劑效應,酸、鹼等催化劑對反應也沒有明顯影響,當反應體系中有氧氣(或有一些能捕捉自由基的雜質存在)時,反應往往有一個誘導期(induction period) 。
熱裂反應
無氧存在時,烷烴在髙溫(800℃左右)發生碳碳鍵斷裂,大分子化合物變為小分子化合物,這 個反應稱為熱裂(pyrolysis)。石油加工後除得汽油外,還有煤油、柴油等相對分子質量較大的烷烴;通過熱裂反應,可以變成汽油、甲烷、乙烷、乙烯及丙烯等小分子的化合物,其過程很複雜,產 物也複雜;碳碳鍵、碳氫鍵均可斷裂,斷裂可以在分子中間,也可以在分子一側發生;分子愈大,愈易斷裂,熱裂後的分子還可以再進行熱裂。熱裂反應的反應機制是熱作用下的自由基反應,所用的原料是混合物。
熱裂後產生的自由基可以互相結合。熱裂產生的自由基也可以通過碳氫鍵斷裂,產生烯烴。
總的結果是大分子烷烴熱裂成分子更小的烷烴、烯烴。這個反應在實驗室內較難進行,在工業上 卻非常重要。工業上熱裂時用烷烴混以水蒸氣在管中通過800℃左右的加熱裝置,然後冷卻到 300~400°C,這些都是在不到一秒鐘時間內完成的,然後將熱裂產物用冷凍法加以一一分離。塑膠、橡膠、纖維等的原料均可通過此反應得到。
乙烯的世界規模年產數千萬噸,而且還在不斷增長。各國所用烷烴原料 不同,產物也有差別,如用石腦油為原料熱裂後可得甲烷15%、乙烯31.3%、乙烷3.4%、丙烯13.1 %、丁二烯4.2%、丁烯和丁烷2.8%、汽油22%、燃料油6%,尚有一些少量其它產品。
一般在碳鏈中間較易斷裂,然後再產生一系列的β-斷裂。
石腦油中還有支鏈烷烴、環烷烴、芳香烴,如環烷烴熱裂可得乙烯與丁二烯。
芳香烴僅在側鏈上發生反應,因芳環穩定,保持不變。因此,如生產乙烯最好是含直鏈烷烴最多的石油餾分。
如用催化劑進行熱裂反應可降低溫度,但反應機理就不是自由基反應而是離子型反應。
氧化反應和燃燒
在生活中經常碰到這樣的現象,人老了皮膚有皺紋,橡膠製品用久了變硬變黏,塑膠製品用 久了變硬易裂,食用油放久了變質,這些現象稱為老化。老化過程很慢,老化的原因首先是空氣 中的氧進入具有活潑氫的各種分子而發生自動氧化反應(autoxidaticm),繼而再發生其它反應。
所有的烷烴都能燃燒,完全燃燒時,反應物全被破壞,生成二氧化碳和水,同時放出大量熱。
燃燒時火焰為淡藍色,不明亮。
硝化反應
烷烴與硝酸或四氧化二氮進行氣相(400~450℃)反應,生成硝基化合物(RNO2)。 這種直接生成硝基化合物的反應叫做硝化(nitration),它在工業上是一個很重要的反應。它之所以重要是由於硝基烷烴可以轉變成多種其它類型的化合物,如胺、羥胺、腈、醇、醛、酮及羧酸等。此外,硝基烷烴可以發生多種反應,故在近代文獻中有關硝基烷烴的套用的報導日益增多。 在實驗室中採用氣相硝化法有很大的局限性,所以實驗室內主要通過間接方法製備硝基烷烴。 氣相硝化法製備硝基烷烴,常得到多種硝基化合物的混合物。
磺化及氯磺化
烷烴在高溫下與硫酸反應,和與硝酸反應相似,生成烷基磺酸,這種反應叫做磺化(sulfonation)。
長鏈烷基磺酸的鈉鹽是一種洗滌劑,稱為合成洗滌劑,例如十二烷基磺酸鈉即其中的一種。
高級烷烴與硫醯氯(或二氧化硫和氯氣的混合物)在光的照射下,生成烷基磺醯氯的反應稱為氯磺化。磺醯氯這個名稱是由硫酸推衍出來的。硫酸去掉一個羥基後剩下的基閉稱為磺(酸)基,磺(酸)基和烷基或其它烴基相連而成的化合物統稱為磺酸。磺酸中的羥基去掉後,就得磺醯基,它與氯結合,就得磺醯氯。
磺醯氯經水解,形成烷基磺酸,其鈉鹽或鉀鹽即上述的洗滌劑。其反應機理與烷烴的氯化很相似。
製備
碳氫化合物的主要來源是天然氣(natural gas)和石油(petroleum)。儘管各地的天然氣組分不同,但幾乎都含有75%的甲烷、15%的乙烷及5%的丙烷,其餘的為較高級的烷烴。而含烷烴種類最多的是石油,石油中含有1至50個碳原子的鏈形烷烴及一些環狀烷烴,而以環戊烷、環己烷及其衍生物為主,個別產地的石油中還含有芳香烴。我國各地產 的石油,成分也不相同,但可根據需要,把它們分餾成不同的餾分加以套用。烷烴不僅是燃料 的重要來源,而且也是現代化學工業的原料。另外,烷烴還可以作為某些細菌的食物,細菌食用烷烴後,分泌出許多很有用的化合物,也就是說烷烴經過細菌的“加工”後,可成為更有用的化合物。
上述情況表明,石油工業的發展對於國民經濟以及有機化學的發展都非常重要。
石油雖含有豐富的各種烷烴,但這是個複雜混合物,除了 C1~C6烷烴外,由於其中各組分的相對分子質量差別小,沸點相近,要完全分離成極純的烷烴,較為困難。採用氣相色譜法, 雖可有效地予以分離,但這隻適用於研究,而不能用於大量生產。因此在使用上,只把石油分離成幾種餾分來套用,石油分析中有時需要純的烷烴作基準物,可以通過合成的方法製備。
餾分
| 分餾區間
| 主要成分
| 燃料的套用
|
|---|
燃氣
| bp 20℃以下
| C1~C4
| 煉油廠燃料,液化石油氣
|
汽油
| bp 30℃~75℃
| C4~C8
| 辛烷值較低,用作車用汽油的摻和組分
|
石腦油
| bp 75℃~190℃
| C8~C12
| 辛烷值太低,不直接用作車用汽油
|
煤油
| bp 190℃~250℃
| C10~C16
| 家用燃料,噴氣燃料,拖拉機燃料
|
瓦斯油
| bp 250℃~350℃
| C15~C20
| 柴油,集中取暖用燃料
|
常壓渣油
| bp 350℃以上
| C20以上
| 發電廠、船舶和大型加熱設備用的燃料
|
汽油(petrol)在內燃機中燃燒而發生爆燃或爆震,這會降低發動機的功率並會損傷發動機。燃料引起爆震的傾向,用辛烷值(octane value)表示,在汽油燃燒範圍內,將2,2,4-三甲基戊烷的辛烷值定為100。辛烷值越高,防止發生爆震的能力越強。六個碳以上的直鏈烷烴辛烷值很低,帶支鏈的、不飽和的脂環、特別是芳環最為理想,有的超過100。大部分現代化的設備要求辛烷值在90~100之間。可將石腦油、常壓渣油,有時也用瓦斯油經過加工,將辛烷值提髙到95左右,再摻入汽油中使用。加工方法之一是催化重整(catalytic reforming),主要將石腦油中C6以上成分芳構化(aromatization),即成芳香烴。此法除使石腦油提高辛烷值外,在化工中主要用來生產芳香烴加工方法之二為催化裂化,此法除能提高辛烷值外,在化工中主要用於生產丙烯、丁烯。
命名規則
烷烴的命名法常用的有3種,現分述如下(僅限於我國):
普通命名法
普通命名法亦稱習慣命名法,適用於比較簡單的烷烴。碳原子數在10以下的烷烴,分別用甲、乙、丙、丁、戊、己、庚、辛、壬、癸等天干名稱表示碳原子數目,例如:CH4稱為甲烷,C2H6稱為乙烷,C3H8稱為丙烷,余此類推;碳原子數在10以上時用漢文數字表示,例如C11H24稱為十一烷,C18H38稱為十八烷。
為了區別異構體,可用“正”、“異”、“新”等作前綴來表示。例如:
正己烷
CH3—CH2—CH2—CH2—CH2—CH3
異己烷
CH3—CH—CH2—CH2—CH3
∣
CH3
新己烷
CH3
|
CH3—CH—CH—CH3
|
CH3
2,2-二甲基丁烷
CH3
∣
CH3—C—CH2—CH3
∣
CH3
衍生物命名法
衍生物命名法是以甲烷為母體,把其他烷烴看作是甲烷的烷基衍生物來命名。在命名時選擇連有烷基最多的碳原子,烷基按大小順序排列,較小的排在前面。例如:
CH3—CH—CH2—CH3
∣
CH3
二甲基乙基甲烷
二甲基乙基異丙基甲烷
這種命名法雖然能反映出烷烴的分子構造,但仍不適用於構造更為複雜的烷烴。
系統命名法
這是採用國際上通用的IUPAC命名原則,並結合我國的文字特點而制定的系統命名法。直鏈烷烴的命名與普通命名法基本一致,只是把“正”字省略;而把帶有支鏈的烷烴看作是直鏈烷烴的烷基衍生物,並按下列規定命名:
(1)選擇分子中最長的碳鏈為主鏈,把支鏈烷基看做主鏈上的取代基,根據主鏈所含的碳原子數稱為某烷。
(2)由距離支鏈最近的一端開始,將主鏈的碳原子用阿拉伯數字編號,支鏈所在的位置以它所連線的碳原子的號數表示。
(3)把取代基的名稱寫在烷烴名稱的前面,如果主鏈上含有幾個不同的取代基時,按照由小到大的順序排列;如果含有幾個相同的取代基,可以在取代基名稱前面用二、三、四……來表示。
如果從碳鏈的任一端開始,第一個取代基的位置都相同時,則要求表示所有取代基位置的數字之和是最小的數。