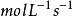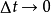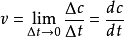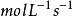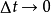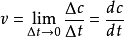背景知識
化學反應速率及表示方法
化學反應速率是指在單位時間內反應物或生成物濃度的變化值。反應速率的單位是
。速率有平均速率和瞬時速率之分。反應速率可以選用反應體系中任一物質濃度的變化來表示,因為反應時各物質變化量之間的關係與化學方程式中的計量係數間的比是一致的。對於氣相反應,化學反應速率可用分壓代替濃度的變化來表示,這時數值和單位都不同。
瞬間速率的定義
對於某一時刻的反應情況,用平均反應速率是反映不出來的,需要用瞬間速率,它是當
時的極限值,表達式為
。
同一反應的瞬時速率,用反應物或者產物的任一物質的單位時間內濃度變化來表示都可以,雖然數值可能不是相同的,但是它們間有著確定的數學關係。
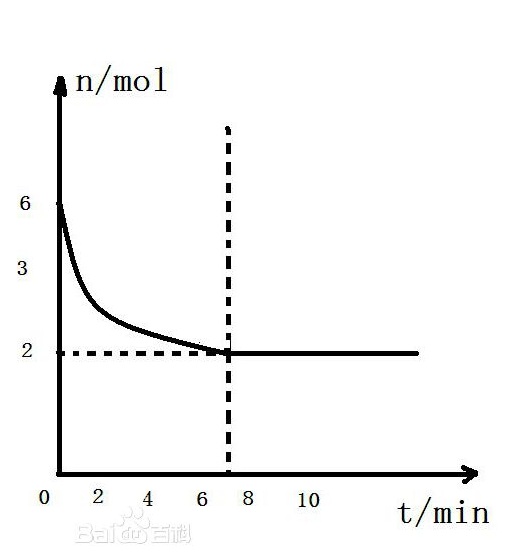
化學反應速率只能通過實驗測得。
因此,瞬間速率也是平均反應速率,其大小也與指定時間以及時間間隔有關。隨著反應的進行,開始時反應物的濃度較大,單位時間內反應的進行,開始時反應物的濃度較大,單位時間反應濃度減小得較快,反應產物濃度增加也較快,也就是反應較快;在反應後期,反應物的濃度變小,單位時間內反應物減小得較慢,反應產物濃度增加也較慢,也就是反應速率較慢。
影響因素
1、內因:反應物本身的性質。
2、外界因素:溫度,濃度,
壓強,催化劑,
光,雷射,反應物顆粒大小,反應物之間的接觸面積和反應物
狀態。另外,
x射線,
γ射線,固體物質的表面積與反應物的接觸面積,反應物的濃度也會影響化學反應速率。
內因
化學鍵的強弱與化學反應速率的關係。例如:在相同條件下,
氟氣與氫氣在暗處就能發生爆炸(反應速率非常大);
氯氣與氫氣在光照條件下會發生爆炸(反應速率大);溴氣與氫氣在加熱條件下才能反應(反應速率較大);
碘蒸氣與氫氣在較高溫度時才能發生反應,同時生成的
碘化氫又分解(反應速率較小)。這與反應物X—X鍵及生成物H—X鍵的相對強度大小密切相關。
外因
對於有氣體參與的化學反應,其他條件不變時(除體積),增大
壓強,即體積減小,反應物濃度增大,單位體積內
活化分子數增多,單位時間內有效碰撞次數增多,反應
速率加快;反之則減小。若體積不變,加壓(加入不參加此化學反應的氣體)反應速率就不變。因為濃度不變,單位體積內活化分子數就不變。但在體積不變的情況下,加入反應物,同樣是加壓,增加反應物濃度,速率也會增加。若體積可變,恆壓(加入不參加此化學反應的氣體)反應速率就減小。因為體積增大,反應物的
物質的量不變,反應物的濃度減小,單位體積內活化分子數就減小。
2.溫度條件
只要升高溫度,反應物分子獲得能量,使一部分原來能量較低分子變成
活化分子,增加了活化分子的百分數,使得
有效碰撞次數增多,故反應速率加大(主要原因)。當然,由於溫度升高,使分子運動速率加快,單位時間內反應物
分子碰撞次數增多反應也會相應加快(次要原因)。
使用正催化劑能夠降低反應所需的能量,使更多的反應物分子成為活化分子,大大提高了單位體積內反應物分子的百分數,從而成千上萬倍地增大了反應物速率.
負催化劑則反之。催化劑只能改變化學反應速率,卻改不了
化學反應平衡。
4.條件濃度
當其它條件一致下,增加反應物濃度就增加了單位體積的活化分子的數目,從而增加有效碰撞,反應速率增加,但活化分子百分數是不變的。化學反應的過程,就是反應物分子中的原子,重新組合成生成物分子的過程。反應物分子中的原子,要想重新組合成生成物的分子,必須先獲得自由,即:反應物分子中的化學鍵必須斷裂。化學鍵的斷裂是通過分子(或離子)間的相互碰撞來實現的,並非每次碰撞都能是化學鍵斷裂,即並非每次碰撞都能發生化學反應,能夠發生化學反應的碰撞是很少的。
活化分子比普通分子具有更高的能量,才有可能撞斷化學鍵,發生化學反應。當然,活化分子的碰撞,只是有可能發生化學反應。而並不是一定發生化學反應,還必須有合適的取向。在其它條件不變時,對某一反應來說,活化分子在反應物中所占的百分數是一定的,即單位體積內活化分子的數目和單位體積內反應物分子的總數成正比,即活化分子的數目和反應物的濃度成正比。
因此,增大反應物的濃度,可以增大活化分子的數目,可以增加有效碰撞次數,則增大反應物濃度,可以使化學反應的速率增大。
5.其他因素
增大一定量固體的表面積(如粉碎),可增大反應速率,光照一般也可增大某些反應的速率;此外,超音波、電磁波、溶劑等對反應速率也有影響。
溶劑對反應速度的影響
在均相反應中,溶液的反應遠比氣相反應多得多(有人粗略估計有90%以上均相反應是在溶液中進行的)。但研究溶液中反應的動力學要考慮溶劑分子所起的物理的或化學的影響,另外在溶液中有離子參加的反應常常是瞬間完成的,這也造成了觀測動力學數據的困難。最簡單的情況是溶劑僅引起介質作用的情況。
在溶液中起反應的分子要通過擴散穿周圍的溶劑分子之後,才能彼此接觸,反應後生成物分子也要穿過周圍的溶劑分子通過擴散而離開。
擴散——就是對周圍溶劑分子的反覆擠撞,從微觀角度,可以把周圍溶劑分子看成是形成了一個籠,而反應分子則處於籠中。分子在籠中持續時間比氣體分子互相碰撞的持續時間大10-100倍,這相當於它在籠中可以經歷反覆的多次碰撞。
籠效應——就是指反應分子在溶劑分子形成的籠中進行多次的碰撞(或振動)。這種連續反覆碰撞則稱為一次偶遇,所以溶劑分子的存在雖然限制了反應分子作遠距離的移動,減少了與遠距離分子的碰撞機會,但卻增加了近距離分子的重複碰撞。總的碰撞頻率並未減低。
據粗略估計,在水溶液中,對於一對無相互作用的分子,在依次偶遇中它們在籠中的時間約為10-12—10-11s,在這段時間內大約要進行100-1000次的碰撞。然後偶爾有機會躍出這個籠子,擴散到別處,又進入另一個籠中。可見溶液中分子的碰撞與氣體中分子的碰撞不同,後者的碰撞是連續進行的,而前者則是分批進行的,一次偶遇相當於一批碰撞,它包含著多次的碰撞。而就單位時間內的總碰撞次數而論,大致相同,不會有數量級上的變化。所以溶劑的存在不會使活化分子減少。A和B發生反應必須通過擴散進入同一籠中,反應物分子通過溶劑分子所構成的籠所需要的
活化能一般不會超過20kJ/mol,而分子碰撞進行反應的活化能一般子40 -400kJ/mol之間。
由於擴散作用的活化能小很多,所以
擴散作用一般不會影響反應的速率。但也有不少反應它的活化能很小,例如自由基的複合反應,
水溶液中的
離子反應等。則反應速率取決於分子的擴散速度,即與它在籠中時間成正比。
從以上的討論可以看出,如果溶劑分子與反應分子沒有顯著的作用,則一般說來
碰撞理論對溶液中的反應也是適用的,並且對於同一反應無論在氣相中或在溶液中進行,其機率因素P和活化能都大體具有同樣的數量級,因而反應速率也大體相同。但是也有一些反應,溶劑對反應有顯著的影響。例如某些
平行反應,常可藉助溶劑的選擇使得其中一種反應的速率變得較快,使某種產品的數量增多。
溶劑對反應速率的影響是一個極其複雜的問題,一般說來:
⑴溶劑的介電常數對於有離子參加的反應有影響。因為溶劑的介電常數越大,離子間的引力越弱,所以介電常數比較大的溶劑常不利與離子間的
化合反應。
⑵溶劑的極性對反應速率的影響。如果生成物的極性比反應物大,則在
極性溶劑中反應速率比較大;反之,如反應物的極性比生成物大,則在極性溶劑中的反應速率必變小。
⑶
溶劑化的影響,一般說來。作用物與生成物在溶液中都能或多或少的形成溶劑化物。這些溶劑化物若與任一種反應分子生成不穩定的中間化合物而使活化能降低,則可以使反應速率加快。如果溶劑分子與作用物生成比較穩定的化合物,則一般常能使活化能增高,而減慢反應速率。如果活化絡合物溶劑化後的能量降低,因而降低了活化能,就會使反應速率加快。
⑷離子強度的影響(也稱為原鹽效應)。在稀溶液中如果作用物都是
電解質,則反應的速率與溶液的離子強度有關。也就是說第三種電解質的存在對於反應速率有影響。
(5)當金屬與
電解質溶液反應時,如果金屬中含有雜質,就會形成
原電池,使反應速率增加,這就是粗鋅比純鋅與酸的反應速率更快的原因。