發現
1768年,
馬格拉夫研究螢石,發現它與石膏和重晶石不同,判斷它不是一種硫酸鹽,1771年化學家舍勒用
曲頸瓶加熱螢石和硫酸的混合物,發現玻璃瓶內壁被腐蝕。
1810年,法國物理學家
安培根據氫氟酸的性質的研究指出,其中可能含有一種與氯相似的元素.化學家
戴維的研究,也得出同樣的結論。
1813年,英國的戴維用電解氟化物的方法製取氟氣,用金和鉑做容器,都被腐蝕了。後來改用螢石做容器,腐蝕問題雖解決了,但卻得不到氟氣,而他則因患病而停止了實驗。
接著
愛爾蘭的喬治·諾克斯和托馬斯·諾克斯兩兄弟先用乾燥的
氯氣處理乾燥的
氟化汞,然後把一片金箔放在玻璃接收瓶頂部,反應產生了氟氣而未得到氟氣。在實驗中,兩兄弟都嚴重中毒。
繼諾克斯兄弟之後,魯耶特對氟氣作了長期的研究,最後因中毒太深而獻出了生命,年僅32歲.法國的
弗雷迷電解了無水的氟化鈣、氟化鉀和氟化銀,雖然陽極上產生了少量的氣體,但始終未能收集到。
英國化學家哥爾也用
電解法分解氟化氫,但在實驗的時候發生爆炸,顯然產生的少量氟氣與氫發生了反應.他以碳、金、鈀、鉑做電極,在電解時碳被粉碎,金、鈀、鉑被腐蝕。
物理性質
氟氣是淡黃色的氣體,有特殊難聞的臭味。在-188.1℃以下,凝成黃色的液體。在-219.62℃變成黃色結晶體。
相對分子質量:37.9968
熔點(101.325kPa):-219.62℃
沸點(101.325kPa):-188.1℃
液體密度(-188.1℃,S.P.):1507kg/m3
氣體密度(25℃,101.325kPa):1.554kg/m3
相對密度(氣體,空氣=1,25℃,101.325kPa):1.312
比容(21.1℃,101.325kPa):0.6367m3/kg
臨界溫度:-128.8℃
熔化熱(-219.67℃,0.252kPa):13.44 KJ/kg
氣化熱(-188.2℃,101.325kPa):175.51 KJ/Kg
比熱比(氣體,21.1℃,101.325kPa):Cp/Cv=1.358
(77.17K):37.383kPa
(89.40K):162.638kPa
粘度(氣體,0℃,101.325kPa):0.02180mPa?s
(液體,-192.2℃):0.275mPa?S
導熱係數(氣體,0℃,101.325kPa):0.024769W/(m·K)
(液體,-188.1℃):0.159W/(m·K)
折射率(氣體,25℃,101.325kPa):1.000187
(液體,-188.1℃):1.2
電負性:4.0(泡林標度)3.98(新泡林標度)
化學性質
氟氣是一種極具腐蝕性的雙原子氣體,劇毒。氟是
電負度最強的元素,也是很強的氧化劑。在
常溫下,它幾乎能和所有的元素化合,並產生大量的熱能,在所有的元素中,要算氟最活潑了。
除具有最高價態的金屬氟化物和少數純的全氟
有機化合物外,幾乎所有有機物和無機物均可以與氟反應。
大多數金屬都會被氟腐蝕,
鹼金屬在氟氣中會燃燒,甚至連黃金在受熱後,也能在氟氣中燃燒。
2Au + 3F2== 2AuF3
許多非金屬,如矽、磷、硫等同樣也會在氟氣中燃燒。
Si+2F2==SiF4
2P+3F2==2PF3
S+3F2==SF6
如果把氟通入水中,它會把水中的氫奪走,放出
氧氣。鉑在
常溫下不會被氟腐蝕(高溫時仍被腐蝕)。
2F2+2H2O==4HF+O2
氫與氟的化合異常劇烈,反應生成氟化氫。
H2+F2==2HF
一般情況下,氧與氟不反應。儘管如此,還是存在兩種已知的氧氟化物,即OF2(高於室溫時穩定)和O2F2(極不穩定)。由鹵素自身形成的化合物有ClF、ClF3、BrF3、IF5,IF7。如上所述,碳或大多數烴與過量氟的反應,將生成四氟化碳及少量四氟乙烯或六氟
丙烷。
C+2F2==CF4
通常,氮對氟而言是惰性的,可用作
氣相反應的稀釋氣。氟還可以從許多含鹵素的化合物中取代其它鹵素。大多數有機化合物與氟的反應將會發生爆炸。
氟氣還可以和稀有氣體在特定條件下反應,如Xe和F2混合氣暴露在陽光下可製得二氟化氙。
F2+Xe=陽光=XeF2
氟氣可以和一氧化氮可以直接化合為氟化亞硝醯,和二氧化氮直接化合為氟化硝醯。
2NO+F2==2NOF
2NO2+F2==2NO2F
硫酸鈉和氟氣反應可以得到氟化亞硫醯。
Na2SO4+2F2=300℃=2NaF+SO2F2+O2
將氟氣通過2%的氫氧化鈉溶液還可以得到氟氧化合物OF2。
2F2+2NaOH=OF2+H2O+2NaF
製備
工業製法:電解氟氫化鉀與氟化氫的混合物,以壓實的石墨做陽極,鋼製電解槽槽身做陰極,以氟化氫鉀為電解質,進行無水氫氟酸的電解,再經淨化而得。生產中,溫度在260℃左右的為高溫法,在95℃左右的為中溫法。
電解總反應式:2KHF2==2KF+H2↑+F2↑
常加入氟化鋰或氟化鋁來降低電解質熔點及減輕碳電極的極化作用,不斷補充HF。
工藝流程圖為:
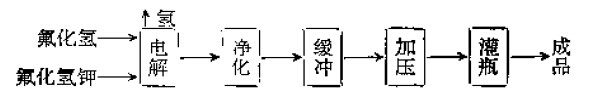 氟氣生產工藝流程圖
氟氣生產工藝流程圖化學製法:用氟錳酸鉀與五氟化銻共熱得到。
K2MnF6+SbF5==K2SbF7+MnF4
2MnF4==2MnF3+F2↑
用途
1、製造氟化物:利用氟氣和水的反應,氟氣可以用於製備氫氟酸(HF:2H
2O+2F
2==4HF+O
2),氫氟酸在鋁和
鈾的提純、蝕刻玻璃、半導體工業中除去矽表面的氧化物,多種含氟有機物的合成等方面都起著重要作用,氟氣還可用於製備氟化鈉,氟化鈉可作為木材防腐劑、農業殺蟲劑、釀造業
殺菌劑、醫藥防腐劑、焊接助焊劑、鹼性鋅酸鹽鍍鋅添加劑等。
2、製造含氟塑膠:利用氟氣和塑膠的反應可以製備含氟塑膠,含氟塑膠具有耐高溫、耐油、耐高真空及耐酸鹼、耐多種化學藥品的特點,已套用於現代航空、飛彈、火箭、宇宙航行、艦艇、原子能等尖端技術及汽車、造船、化學、石油、電訊、儀器、機械等工業領域。
4、原子能工業:通過氟從鈾礦中提取鈾235,因為鈾和氟的化合物很易揮發,用
分餾法可以把它和其它雜質分開,得到十分純淨的鈾235。鈾235是製造核子彈的原料。在鈾的所有化合物中,只有
氟化物具有很好的揮發性能。
5、航空:由於氟氣氧化性很強,液化的氟氣可作為火箭燃料中的氧化劑。
6、其他方面:氟氣還用於金屬的焊接和切割,電鍍,玻璃加工,藥物,農藥,殺鼠劑,冷凍劑,等離子蝕刻等。
毒性
氟是劇毒性氣體,能刺激眼、皮膚、呼吸道黏膜。當氟濃度為5~10ppm時,對眼、鼻、咽喉等黏膜開始有刺激作用,作用時間長時也可引起
肺水腫。與皮膚接觸可引起毛髮的燃燒,接觸部位
凝固性壞死、上皮組織碳化等。慢性接觸可引起骨硬化症和韌帶鈣化。吸入氟的患者應立即轉移至無污染的安全地方安置休息,並保持溫暖舒適。眼睛或皮膚受刺激時迅速用水沖洗之後就醫診治。
安全防護
工作場所要通風保持空氣新鮮乾燥。要用特種鋼瓶貯裝。鋼瓶存放時必須與其它物料隔離,特別是與能和氟反應的物料隔絕,要遠離易起火地點。
著火時消防人員須在防爆掩蔽處操作,切不可將水直接噴射漏氣處,否則會助長火勢。滅火可用二氧化碳、乾粉、砂土、廢氣可用水吸收。
儲存運輸
氟氣屬有毒
壓縮氣體,宜儲存於陰涼、通風倉內,並應遠離火種、熱源。實行“雙人收發、雙人保管”制度。遠離火種、熱源。庫溫不超過30℃。應與易(可)燃物、活性金屬粉末、食用化學品分開存放,切忌混儲。儲區應備有泄露應急處理設備。
鐵路運輸時須報鐵路局進行試運,試運期為兩年。試運結束後,寫出試運報告,報鐵道部正式公布運輸條件。鐵路運輸時應嚴格按照鐵道部《危險貨物運輸規則》中的危險貨物配裝表進行配裝。採用剛瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。嚴禁與易燃物或可燃物、活性金屬粉末、食用化學品等混裝混運。夏季應早晚運輸,防止日光曝曬。公路運輸時要按規定路線行駛,禁止在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。
 氟氣生產工藝流程圖
氟氣生產工藝流程圖
