眼鏡蛇毒因子(cobra venom factor,CVF)是從眼鏡蛇毒中分離純化的一種具有抗補體成分的酸性糖蛋白,它與補體C3有結構同源性。CVF具有長效的去補體作用,被廣泛套用於異種器官移植研究。
簡介,CVF生化性質,化學性質,胺基酸序列,醫學作用,CVF的免疫學作用,臨床套用,
簡介
眼鏡蛇毒因子(Cobra venom factor,CVF),又稱為眼鏡蛇毒抗補體蛋白(Cobra anticomplementary protein)。是眼鏡蛇毒中的主要抗補體成分,20世紀初Flexner和Noguchi即發現眼鏡蛇毒具有抗補體作用。到20世紀60年代,Nelson、Muller等發現眼鏡蛇毒中抗補體的主要成分是CVF。從20世紀60年代到20世紀80年代的二十年里,許多實驗室用各種方法分離提純眼鏡蛇毒因子,其理化性質、體內代謝動力學、分子生物學特性、免疫學作用才逐漸被闡明。1994年Fritzuger等還克隆得到了CVF的cDNA序列。由於CVF具有長效的脫補體作用,因此被廣泛套用於基礎醫學的研究,具有廣闊的臨床套用前景,正日益受到人們的關注。
所謂抗補體作用,指對抗生物體的排斥反應的能力。超急性排斥反應主要由於天然抗體與異種抗原結合和(或)受者補體系統的激活產生過敏素C3a和C5a,C3a可致平滑肌收縮,增加血管通透性,嗜鹼性白細胞脫粒並釋放組胺,導致供器官血管內皮細胞的激活而表現為供器官組織間隙水腫、出血、血管充血及廣泛血管內血栓形成等病理改變致使供器官迅速失活凋亡。超急性排斥反應是異種移植的第一道障礙,研究表明,單獨消除補體就能使非協調性異種移植存活明顯延長,使超急性排斥反應得以控制。補體抑制劑主要包括CVF,ScR1,C1抑制因子,以CVF作用最強。其作用機制是與B因子結合,在D因子作用下將C3裂解為C3a和C3b,從而消耗C3,達到將補體經典途徑和旁路途徑同時抑制的作用。傳統的免疫抑制劑環磷醯胺(CYP)和激素只能短時延緩超急性排斥反應的發生。眼鏡蛇毒因子具有特異性抗補體C3生物活性,其結構與功能類似補體組分C3,在血清中其它蛋白因子的參與下,與補體系統中的C3成分形成複合物,代替內源性的組分C3b,激活旁路途徑,降解C3(和C5),導致體內補體C3(和C5)的耗竭,因而產生抑制體液免疫作用。研究人員用不同產地眼鏡蛇毒提純的CVF套用於異種移植獲得明顯效果,在豚鼠至大鼠異種心臟、腎臟移植能將存活延長至3d左右。
CVF生化性質
化學性質
CVF是一種帶負電荷較多的球狀糖蛋白分子,由α、β、γ三個亞基通過二硫鍵及其它非共價鍵的次級鍵相互聯接而成。在電子顯微鏡下,CVF分子呈圓柱形,一端稍寬(137±13×82±11)。它的分子量因各實驗室提純方法、測定分子量的方法及眼鏡蛇毒來源的不同而有所差異。全分子CVF的分子量為130000-230000(道爾頓,以下同),三個亞基的分子量分別為:α:66000-87000;β:47000-75000;γ:28000-66000。等電點(pI)為5.2-6.5。CVF對溫度有較好的穩定性,10-65℃穩定,65℃以上迅速變性失活。 眼鏡蛇毒因子糖鏈結構
眼鏡蛇毒因子糖鏈結構
 眼鏡蛇毒因子糖鏈結構
眼鏡蛇毒因子糖鏈結構胺基酸序列
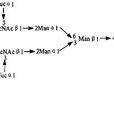
CVF的胺基酸組成沒有特殊性,含有較多的酸性胺基酸,二級結構以β摺疊為主,占47%;α-螺旋占11%。CVF經碳水化合物分析發現,其糖的含量約占2.8-7.4%,其中有較多的岩藻糖,極少有唾液酸。α鏈有2-3個糖基化位點,β鏈有一個,γ鏈則沒有。寡糖鏈主要是雙天線複合型,末端為非還原的α-半乳糖殘基,以N-糖苷鍵與肽鏈上的天冬醯胺連線。CVF脫糖基化後,其二級結構無明顯變化,對其補體激活作用亦沒有較大的影響。由此推測CVF的寡糖鏈不是其補體激活作用所必需的,而可能與CVF的熱穩定性有關。 眼鏡蛇毒因子合成路線模擬圖
眼鏡蛇毒因子合成路線模擬圖
 眼鏡蛇毒因子合成路線模擬圖
眼鏡蛇毒因子合成路線模擬圖1994年Fritzinger等首先報導CVF的cDNA序列。CVF的mRNA全長5924核苷酸(nt),5'端前3nt和3'端的994nt不翻譯,中間為—4962nt的開放讀碼框,可翻譯成1642個胺基酸的前蛋白原,如圖2所示。CVF前蛋白原的N-端22個胺基酸殘基為信號肽,富含疏水性胺基酸。信號肽後為627個胺基酸殘基的α鏈,α鏈有3個N-糖苷化位點(131,136,187)。α鏈的C端連線4個精氨酸殘基及一個類似C3a的79胺基酸殘基的肽段,類C3a肽段的640位有一個糖苷化位點。γ鏈始於711位胺基酸殘基,但其C末端未確定,可能具有種間特異性。γ鏈C末端連線279個胺基酸殘基的類C3d肽段。CVF的β鏈從1242位胺基酸起延伸379個胺基酸殘基,在1324位有一個N-糖苷化位點。CVF的前蛋白原的類C3a,類C3d肽段在翻譯後被切除,成熟的CVF中沒有這兩個肽段。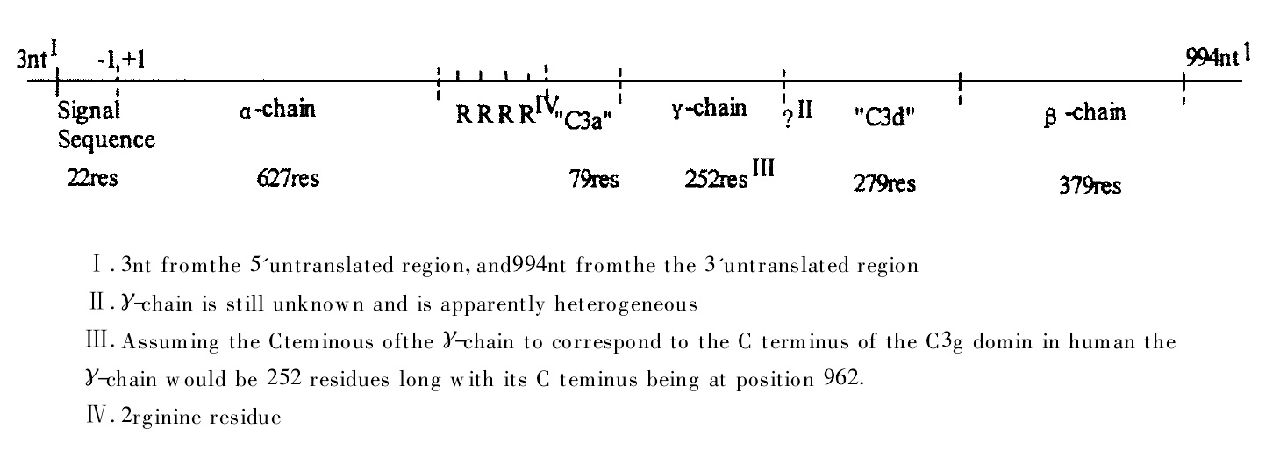 眼鏡蛇毒因子DNA序列及延伸胺基酸序列
眼鏡蛇毒因子DNA序列及延伸胺基酸序列
 眼鏡蛇毒因子DNA序列及延伸胺基酸序列
眼鏡蛇毒因子DNA序列及延伸胺基酸序列醫學作用
CVF的免疫學作用
補體系統(complement)是機體免疫系統的一個重要組成部分,由30餘種血漿蛋白和膜蛋白組成的一個龐大而複雜的非特異免疫系統,補體系統的過度激活會產生大量的過敏毒素(C3a、C4a和C5a),進一步激活單核巨噬細胞及中性粒細胞迅速產生TNF-α、IL-1及IL-6等大量的促炎細胞因子及其他炎症介質,參與肺損傷的發生與發展。眼鏡蛇毒因子(CVF)是從眼鏡蛇毒液中提取的一個無毒的糖蛋白。它能裂解C3和C5,是補體的旁路激活物。既能激活補體又能最終耗竭補體。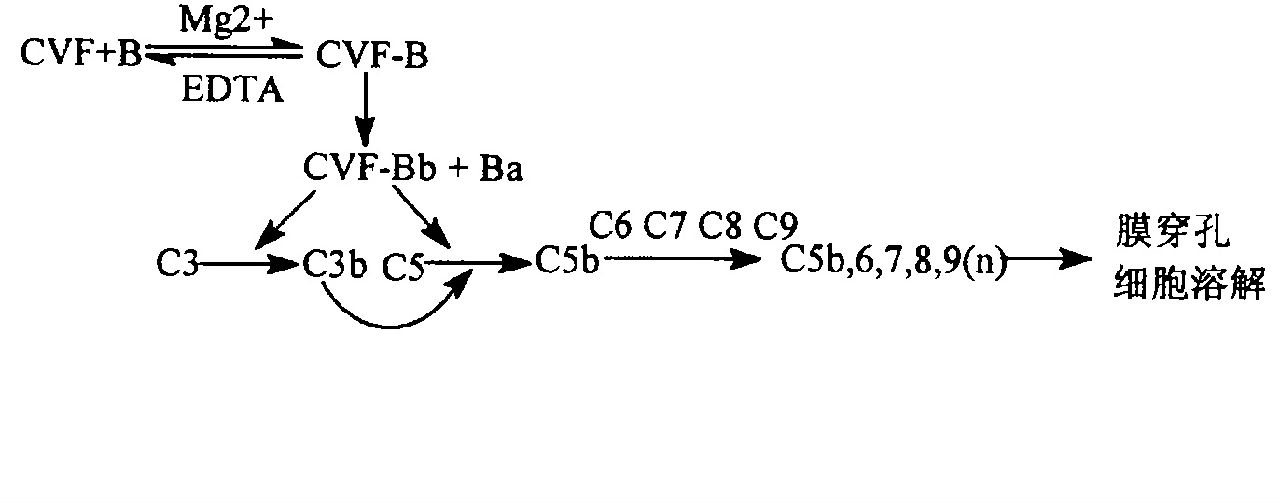 眼鏡蛇毒因子對補體激活替代途徑的影響
眼鏡蛇毒因子對補體激活替代途徑的影響
 眼鏡蛇毒因子對補體激活替代途徑的影響
眼鏡蛇毒因子對補體激活替代途徑的影響CVF是一個球形的糖蛋白,與補體C3是在進化中形成的同源分子,結構類似C3a,在Mg2+存在下,與B因子可逆結合。複合物CVF-B隨即被血清中的D因子水解成兩個片段,CVF-Bb和Ba,CVF-Bb在血液中可存在6-7 h,小片段Ba被釋放出來。產物CVF-Bb是個補體激活替代途徑(Alternative pathway)的C3/C5轉化酶,具有絲氨酸蛋白酶活性,能水解C3的α鏈77位肽鍵(Arg-Ser)及C5的α鏈74位肽鍵(Arg-Leu),形成C3b、C5b,釋放過敏毒素C3a、C5a。C3b、C5b促使膜攻擊複合物的形成,導致細胞膜穿孔、細胞溶解。同時造成C3、C5-C9成分耗竭,大鼠腹腔注射CVF(1 mg/kg)2 h後血中C3基本耗竭。
1983年Eggersten等利用免疫印跡技術證實了CVF的α鏈與C3的β鏈有相同的抗原決定簇,而CVF的β、γ鏈與C3的抗血清無免疫交叉反應。隨後Vogel等人從CVF與C3胺基酸組成、N-末端序列、遠紫外、近紫外、圓二色光譜二級結構、等電點及超微結構等方面進行比較分析,推測CVF與C3是同一祖先蛋白分子進化而來,是C3存在的另一種選擇形式。比較CVF與C3的mRNA,發現兩者相似程度超過50%,蛋白質水平的相似程度更超過70%,尤其是27個半胱氨酸殘基,形成硫酯鍵的位點,B因子的結合位點高度保守。另一方面,CVF與C3中糖的含量與類型有很大的差異。①CVF的糖含量(2.8-7.4%)明顯高於人的C3(1.7%)。②CVF的α、β鏈的寡糖鏈為高岩藻糖取代的複合型,而人類C3的α、β鏈的寡糖鏈為高甘露糖型。③CVF寡糖鏈末端為α-半乳糖殘基,而哺乳動物體內的α-半乳糖轉移酶基因是被抑制的。
CVF與C3的降解產物C3b片段相似,都以1∶1的比例可逆地與B因子結合成複合物,經D因子水解活化後,形成C3轉化酶,催化膜攻擊複合物的形成。然而,CVF與C3主要有三方面的不同:①CVF-Bb比C3b-Bb更穩定。37℃時CVF-Bb的半衰期為7h,而C3b-Bb的半衰期只有1.5分鐘;②與C3b不同,CVF有抗調節蛋白H、I因子的作用,因此CVF-Bb不易被解離,這可能是CVF-Bb有較長半衰期的原因;③CVF-Bb不僅能激活C3,同時也能激活C5,而C3b-Bb只能激活C3,對C5沒有激活作用。
眼鏡蛇蛇毒中除了CVF,還有另外兩種與補體系統相互作用的成分——高分子眼鏡蛇蛇毒因子和補體抑制劑。高分子量眼鏡蛇毒因子(High molecular weight cobra factor H-CVF)是Ballow等分離CVF時發現的,分子量大於800000,不水解血清中的C3。抗補體活性為眼鏡蛇毒總抗體活性的3%,作用於補體激活途徑的前幾個步驟。補體抑制劑(Cobra Inhibitor,CI),是Von Zaber等在1981年發現的,它是一個小分子(分子量約為26000)、熱不穩定的鹼性糖蛋白。CI作用於補體影響系統的多個步驟,影響補體激活的經典途徑和替代途徑。
研究發現CVF的重要靶器官是肝臟;小鼠靜脈注射CVF後,其血漿清除半衰期為10h;而腹腔注射後,6h血中CVF的含量達到最大值,血漿清除半衰期是18h。由於CVF的性質穩定,半衰期長,因此能不斷激活補體引起補體的耗竭。據文獻報導,大鼠腹腔注射CVF15h後血中的C3的含量降低至正常水平的5%左右;分批註射CVF,則在1-4天內血漿中的C3能降低至正常的5%以下。豚鼠腹腔注射CVF 2天后,角膜的補體水平能降至很低,並能保持6天。隨著對CVF理化性質和動物體內代謝動力學的研究的不斷深入,CVF作為一種有效的脫補體劑,越來越廣泛地套用於免疫學基礎研究及臨床研究。
臨床套用
20世紀70年代,Pepys就發現了CVF能抑制大鼠體內依賴於胸腺的抗體特別是IgG組分的產生。1986年Bottger等報導CVF能夠抑制噬菌體φ×174(T細胞依賴性抗原)在豚鼠體內引起的體液免疫反應。CVF多用於誘導補體缺陷的動物模型,或用於處理各種患病動物模型,以研究補體系統在疾病發病機制中的作用。如Pang等發現CVF能抑制維生素D誘導的大鼠動脈硬化;任先達等人發現CVF對家犬呼吸窘迫綜合症具有保護作用。
20世紀80年代初Vogel等就報導了CVF的一個相當重要套用,即利用CVF與腫瘤相關抗原的單克隆抗體共價結合,選擇性地殺傷、消滅腫瘤。20世紀90年代,CVF-單抗結合物的抗腫瘤作用的研究越來越廣泛和深入,針對不同腫瘤的特異性殺滅方面的研究取得了長足的進展。Juhl等發現CVF-單抗結合物能促進腫瘤細胞特異性地攝入抗癌胚抗原的抗體;不同的CVF-單抗結合物對人神經母胞瘤有不同的細胞毒性。Wang等報導CVF-單抗結合物對人鼻咽癌細胞具有選擇性的細胞毒作用。
CVF的另一重要的臨床套用研究是利用它可以抑制補體系統,克服異種移植引起的超急排斥反應和急性血管排斥反應,是器官異種移植臨床套用中有發展潛力的新型抗排斥藥物。1985年Knechtle等人在比較CVF、環孢黴素、全身淋巴照射在抗超急排斥反應方面的作用時發現,在同種異體大鼠心臟移植前,對超敏狀態的大鼠進行全身淋巴照射或合併注射環孢黴素都無法有效延長大鼠的生存期;而用CVF耗竭補體,能使器官存活時間由20.4±16.6h(或35.6±6.2h)延長至114.4±31.0h,從而推測CVF能延遲超急性反應的發生。CVF與環孢菌素聯合,套用於倉鼠-大鼠的異種心臟移植;與環孢菌素、IgG EXAC(xenoreactive antibody)合用,套用於小鼠-大鼠的異種心臟移植,單獨套用於在豬-狒狒的心臟移植;實驗結果均表明CVF能有效抑制超急排斥反應而延長宿主的存活時間。
不過,CVF作為一種異種蛋白,本身具有抗原性,注射後抗CVF抗體快速產生,減弱其效應;而且CVF耗竭補體為全身性,靶向性差,會增加感染的機會。此外,CVF激活補體過程中產生的補體片段會增強白細胞趨化、黏附和吞噬作用,對內皮細胞產生濃度依賴性損傷,並啟動血管內凝血機制。因此在異種移植中應儘可能用較小劑量的CVF作補體抑制劑。