基本介紹
- 中文名:攻膜複合物
- 外文名:membrane attack complex
物質介紹
形成過程
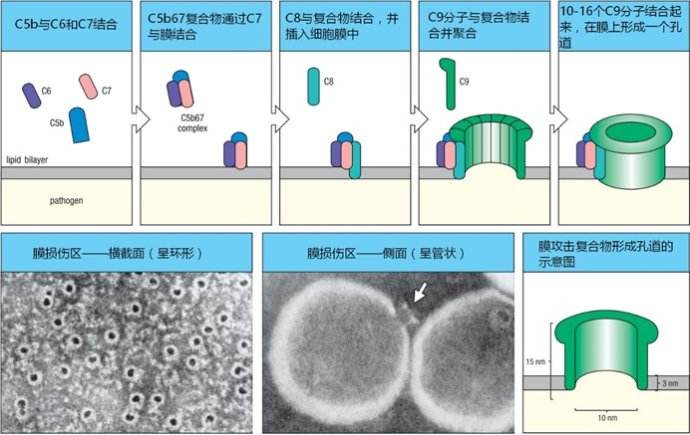
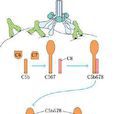

攻膜複合物是指補體溶細胞生物學效應的效應複合體,為三條補體激活途徑的共同末端通路,即膜攻擊複合物(membrane attack complex, MAC)。在免疫學中指補體激活後產生...
MAC(membrane attack complex),指在免疫學中指補體激活後產生的膜攻擊複合體。...... MAC(membrane attack complex),指在免疫學中指補體激活後產生的膜攻擊複合體。...
中文名稱 攻膜複合物抑制因子 英文名稱 membrane attack complex inhibitory factor;MACIF 定義 一類細胞表面蛋白質。通過阻斷攻膜複合物的形式保護宿主細胞免受...
中文名稱 攻膜複合物非致死效應 英文名稱 non-lethal effect of the MAC 定義 亞裂解劑量的攻膜複合物組裝於有核細胞膜表面所致的一系列效應。影響細胞代謝,...
二、激活補體產生攻膜複合物使細胞溶解破壞人IgG1~3和IgM與相應抗原結合後,可因構象改變而使其CH2和CH3結構域內的補體結合點暴露,從而通過經典途徑激活補體系統,...
補體激活途徑之一。指微生物或外源異物直接激活C3,在B因子、D因子和備解素參與下,形成C3轉化酶與C5轉化酶,最終形成攻膜複合物。...
旁路激活路徑是指微生物或外源異物直接激活C3,在B因子、D因子和備解素參與下,形成C3轉化酶與C5轉化酶,最終形成攻膜複合物。直接激活C3繼而完成C5至C9各成分的連鎖...
補體受體存在於多種細胞.CR1(CD35),膜輔助因子蛋白(MCP,CD46)和DAF(CD55)對C3b的分解起調節作用.HRF和CD59防止在自身細胞形成攻膜複合物.CR1(CD35)在清除...
補體依賴的細胞毒性(complement dependent cytotoxicity;CDC ),指的是補體參與的細胞毒作用,即通過特異性抗體與細胞膜表面相應抗原結合,形成複合物而激活補體經典途徑,...
