瓦爾登反轉,即化學反應中,分子在手性中心發生的構型轉換現象。
基本介紹
- 中文名:瓦爾登反轉
- 外文名:W.inversion
- 實驗家:P.Von Walden
- 時間:19世紀末
發現過程,舉例,SN2反應,光延反應,研究進展,原理,實驗過程,
發現過程
這一現象最早是由德國化學家保羅·瓦爾登(Paul Walden)在1896年發現的。他發現,用五氯化磷在醚中處理(−)-蘋果酸4,可得(+)-氯代琥珀酸1,後者用氫氧化銀處理得到了(+)-蘋果酸2。同樣,(+)-蘋果酸在用五氯化磷處理時,得到(−)-氯代琥珀酸3,而用氫氧化銀處理(−)-氯代琥珀酸1,又可得回(−)-蘋果酸4。如下圖所示: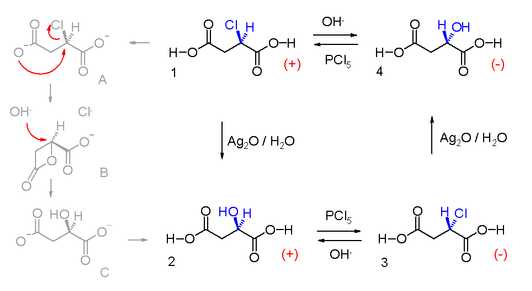 蘋果酸構型轉化
蘋果酸構型轉化
 蘋果酸構型轉化
蘋果酸構型轉化經後人闡明,當蘋果酸與五氯化磷作J仃時,發生了構型反轉。而與濕的氧化銀作用時,構型保持不變。瓦爾登率先發現構型反轉和構型保留現象,故在親核取代等反應中發生的構型反轉現象被稱為瓦爾登反轉或瓦爾登循環。
舉例
SN2反應
是親核取代反應的一類,其中S代表取代(Substitution),N代表親核(Nucleophilic),2代表反應的決速步涉及兩種分子。與SN1反應相對應,SN2反應中,親核試劑帶著一對孤對電子進攻具親電性的缺電子中心原子,形成過渡態的同時,離去基團離去。反應中不生成碳正離子,速率控制步驟是上述的協同步驟,反應速率與兩種物質的濃度成正比,因此稱為雙分子親核取代反應。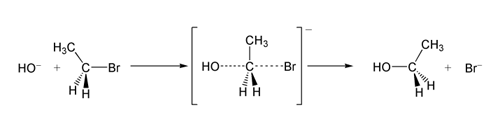

光延反應
一種親核取代反應,由日本化學家於1967年發現,是現代有機合成中常用的反應。在三苯基膦和偶氮二羧酸二乙酯(DEAD)的作用下,醇能夠與多種親核試劑反應,轉化成對應的功能化合物,例如酯。 此反應的特點是條件溫和,產率高,並帶有構型翻轉。
羥基在偶氮二羧酸二乙酯(DEAD)和三苯基膦的作用下被親核試劑取代,同時跟羥基所連的碳原子構型發生反轉(瓦爾登反轉)。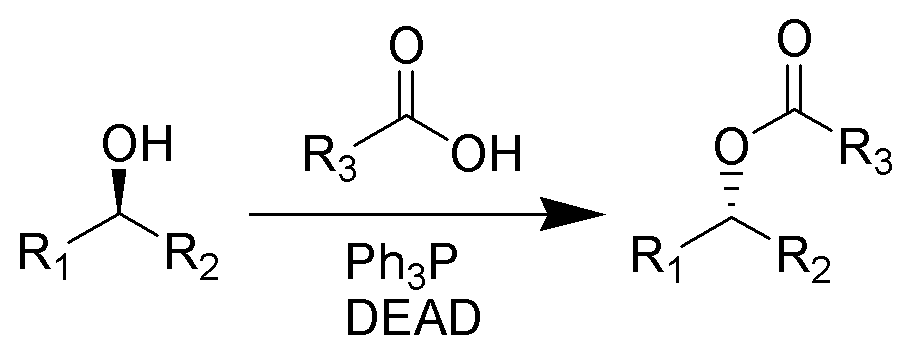 反應方程式
反應方程式
 反應方程式
反應方程式研究進展
原理
發生在四面體環境的碳原子上、經由背面攻擊,是化學中最重要和最有用的一類反應。例如SN2反應中,親核試劑(通常帶負電荷)從一側接近飽和的碳原子,置換碳原子對面一側的離去基團,導致碳中心的翻轉和分子手性的變化。數十年的大量研究表明具有中心勢壘的氣相SN2反應表現出反向二級動力學同位素效應(即當同位素取代的原子並沒有直接參與反應時,室溫下的速率常數kH/kD<1),而反應截面表現出較強的正向二級同位素效應,同時反應的閾值能量遠大於計算的勢壘高度。然而,造成動力學和反應截面同位素效應差異以及高能量閾值的原因一直沒有得到闡明。
實驗過程
1、對H'+CH4→CH3H'+H取代反應及其同位素類似物進行了精確的量子動力學研究。該反應是最簡單的經由背面攻擊瓦爾登翻轉機理實現的反應,過渡態為D3h構型,靜態勢壘高度是1.6eV。理論研究發現反應的閾值能量遠大於勢壘高度,並且反應顯示出不同的同位素效應。
2、分析反應過程中不反應甲基基團傘形角的變化。根據最小能量路徑,傘形角在反應期間應該隨著H原子的入射和斷裂CH鍵的伸長同步變化,在靜態過渡態處達到90°。計算結果表明對於H'+CHD3取代反應,不反應CD3基團的傘形運動在反應期間對入射H原子的攻擊回響非常緩慢,反應並沒有經過圖中黑色反應路徑所示的最小能量路徑。
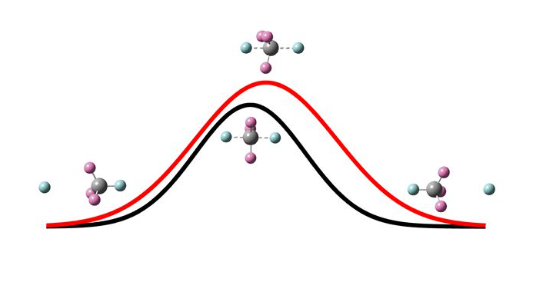 瓦爾登反轉反應機理
瓦爾登反轉反應機理