簡史
古代人類早就學會了取火和用火,但是後來才注意探究熱、冷現象本身,直到17世紀末還不能正確區分溫度和熱量這兩個基本概念的本質。在當時流行的“熱質說”統治下,人們誤認為物體的溫度高是由於儲存的“熱質”數量多。1709~1714年華氏溫標和1742~1745年攝氏溫標的建立,才使測溫有了公認的標準。隨後又發展了量熱技術,為科學地觀測熱現象提供了測試手段,使熱學走上了近代實驗科學的道路。1798年,Count von朗福德觀察到用鑽頭鑽炮筒時,消耗機械功的結果使鑽頭和筒身都升溫。1799年,英國人H.戴維用兩塊冰相互摩擦致使表面融化,這顯然無法由“熱質說”得到解釋。1842年,J.R.von邁爾提出了能量守恆理論,認定熱是能的一種形式,可與機械能互相轉化,並且從空氣的定壓比熱容與定容比熱容之差計算出熱功當量。英國物理學家J.P.焦耳於1840年建立電熱當量的概念,1842年以後用不同方式實測了熱功當量。1850年,焦耳的實驗結果已使科學界徹底拋棄了“熱質說”,公認能量守恆、而且能的形式可以互換的熱力學第一定律為客觀的自然規律。能量單位焦耳(J)就是以他的名字命名的。
熱力學的形成與當時的生產實踐迫切要求尋找合理的大型、高效熱機有關。1824年,法國人S.卡諾提出著名的卡諾定理,指明工作在給定溫度範圍的熱機所能達到的效率極限,這實質上已經建立起熱力學第二定律,但受“熱質說”的影響,他的證明方法還有錯誤。1848年,英國工程師開爾文(即W.湯姆森)根據卡諾定理制定了熱力學溫標。1850年和1851年,德國的R.克勞修斯和開爾文先後提出了熱力學第二定律,並在此基礎上重新證明了卡諾定理。1850~1854年,克勞修斯根據卡諾定理提出並發展了熵。熱力學第一定律和第二定律的確認,對於兩類“永動機”的不可能實現作出了科學的最後結論,正式形成了熱現象的巨觀理論熱力學。同時,也形成了“工程熱力學”這門技術科學,它成為研究熱機工作原理的理論基礎,使內燃機、汽輪機、燃氣輪機和噴氣推進機等相繼取得迅速進展。與此同時,在套用熱力學理論研究物質性質的過程中,還發展了熱力學的數學理論,找到反映物質各種性質的相應熱力學函式,研究了物質在相變、化學反應和溶液特性方面所遵循的各種規律。1906年,德國的W.H.能斯脫在觀察低溫現象和化學反應中發現熱定理。1912年,這個定理被修改成熱力學第三定律的表述形式。20世紀初以來,對超高壓、超高溫水蒸汽等物性和極低溫度的研究不斷獲得新成果。
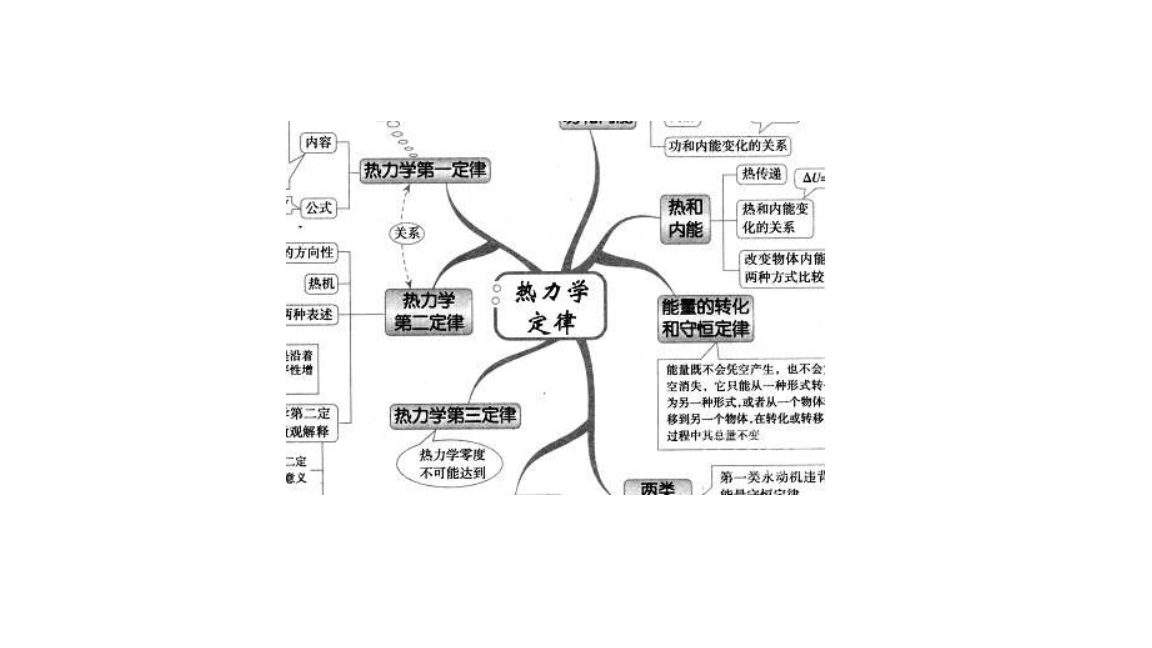
第零定律
熱力學的研究內容涉及一系列與系統的冷熱變化有密切關係的熱效應或熱現象。溫度是熱力學所特有的狀態參量,能具體、直接地表達系統的冷熱特點。
如果兩個熱力學系統中的每一個都與第三個熱力學系統的同一熱狀態處於熱平衡,則這兩個熱力學系統彼此也必定處於熱平衡。這一結論稱為熱力學第零定律,也叫做熱平衡定律。
熱力學第零定律為建立溫度概念提供了實驗基礎,這個定律反映出:處於同一熱平衡狀態的所有的熱力學系統都具有一個共同的巨觀性質,表征處於同一熱平衡的系統所具有的共同巨觀性質的物理量就定義為溫度。 因此,一切互為熱平衡的系統都具有相同的溫度,這也是用溫度計測量物體溫度的依據。
第一定律
做功和熱傳遞都可以改變系統的內能,當改變內能的這兩種方式同時存在的情況下,系統的內能的增量等於在這個過程中外界對系統所做的功和系統所吸收的熱量總和。做功和熱傳遞都可以改變系統的內能,但是本質上還是有區別的。 做功是與巨觀位移相聯繫的,功是過程量,做功的過程就是能量轉化的過程。熱傳遞是通過分子碰撞的方式把高溫物體的內能轉移到低溫物體上去的。
熱力學第一定律是能的轉化和守恆定律在涉及熱現象的過程中的具體形式,也就是說它是能的轉化及守恆定律的特殊形式。人們曾經幻想過製造一種機器,這種機器不需要消耗任何能量還可以源源不斷地對外做功,這種機器被稱為第一類永動機,最終都以失敗而告終。
第二定律
熱力學第二定律是直接從關於熱機效率的研究中發現的。 開爾文和克勞修斯運用熱功轉化的觀點研究了熱機的效率,分別提出了熱力學第二定律的原始表述。開爾文表述為:不可能從單一熱源吸收熱量,使其完全變為有用的功而不產生其他影響。由此可知,效率高於或等於 100% 的熱機是不存在的。如果想要使熱機效率達到100%,則要求工質在一循環過程中,把從高溫熱源吸收的熱量全部變為有用的機械功,而工質本身又回到初始狀態,並不放出任何熱量到低溫熱源去。 這種“理想熱機”並不違反熱力學第一定律,但是嘗試著提高熱機效率的實驗證明,在任何情況下熱機都不可能只有一個熱源,熱機要不斷地把吸收的熱量變為有用的功,就不可避免地把一部分熱量傳遞給低溫熱源,效率必然低於 100%。
從單一熱源吸取熱量並將它完全變為有用的功而不產生其他影響的熱機叫做第二類永動機,所以開爾文表述也可表述為第二類永動機是不可能造成的。
第三定律
不可能使一個物體冷卻到絕對溫度的零度。熱力學零度等於-273.15℃。熱力學零度是低溫的極限,只能無限接近,但不可達到。