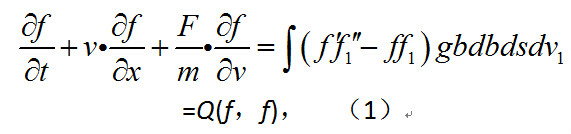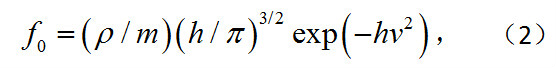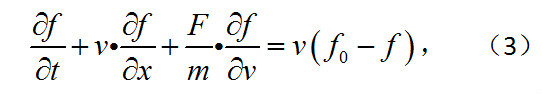正文
氣體分子運動論的基本方程,因L. E. 玻耳茲
曼於1872年首先提出而得名。它是一個非線性積分微分方程,用於描述氣體分子速度分布函式的變化。它對研究
稀薄氣體動力學有重要意義。
根據質點分子或光滑球分子速度分布函式
f(
x,
v,
t)的定義,在時刻
t,
x鄰近的物理空間體積元(記為d
x=d
x1d
x2d
x3)內,速度在靠近
v的速度空間元(記為d
v=d
v1d
v2d
v3)內的分子數目是
fd
x d
v。對於單一組元且相互作用勢為球對稱的氣體分子,如果作用在分子上的外力為
F,則速度分布函式f滿足下述玻耳茲曼方程:
式中m為分子質量;g為碰撞前速度分別為v、v1的兩個分子的相對速度值;b為假設第一個分子靜止時,第二個分子運動軌跡的漸近線到第一個分子重心的垂直距離;g為第二個分子運動軌跡平面同通過第一個分子重心並與相對速度平行的某一固定平面之間的夾角。f1=f(v1),f'=f(v'),f1'=(v1'),v,v1是碰撞前速度為v',v1'的兩個分子碰撞後的速度。式(1)中右端是對所有可能的b、ε、v1之值求積分,稱為碰撞積分,代表由於分子相互碰撞引起的f的變化。上述方程只適用於質點分子或光滑球對稱分子。
對於一般剛性分子,速度分布函式有六個位置變數和六個速度變數。因為,若分子為非球對稱的剛體,除用x決定平動外,還需有三個決定方位的角變數。如果分子表面不光滑,則除了速度v外,尚需有表征分子運動狀態的三個角速度分量。
直接求解玻耳茲曼方程十分困難,平衡狀態的麥克斯韋速度分布實際上是巳知的僅有的精確解:
式中h=/2kTm,k為玻耳茲曼常數;ρ、v和T為平衡態下的密度、速度和溫度。為了簡化,通常提出所謂模型方程,用以近似地代替玻耳茲曼方程。最簡單而常用的方程是所謂B-G-K-W方程,它用v(f0-f)(稱為弛豫項)代替玻耳茲曼方程右端的碰撞積分,即
式中v為碰撞頻率,f0為由式(2)給出的局部麥克斯韋分布。但式中可調參量ρ、v、T應與由解f給出的局部密度、速度、溫度相同。B-G-K-W方程滿足質量、動量、能量在碰撞前後守恆和其解漸近趨於麥克斯韋分布的條件。它比較簡單,且能給出與玻耳茲曼方程近似的結果,因而常被用來代替玻耳茲曼方程。
參考書目
S. Chapman and T. G. Cowing,The Mathematical Theory of Non-uniform Gases, 3rd ed., Cambridge Univ.Press,London,1970.
C. Cercignani,Mathematicl Methods in Kinetic Theory,Plenum Press,New York,1969.