濃差電池是電化學電池的一種。主要部分包括正、負兩個電極與電解質。一般有電極濃差電池和溶液濃差電池兩類。其電動勢取決於物質的濃度差,是由於一種物質從高濃度狀態向低濃度轉移而產生的。
基本介紹
- 中文名:濃差電池
- 外文名:concentration cell
- 分類:電極濃差電池、溶液濃差電池
- 產生:電極兩極存在濃度差
- 別名:腐蝕電池
- 領域:分析化學
基本介紹
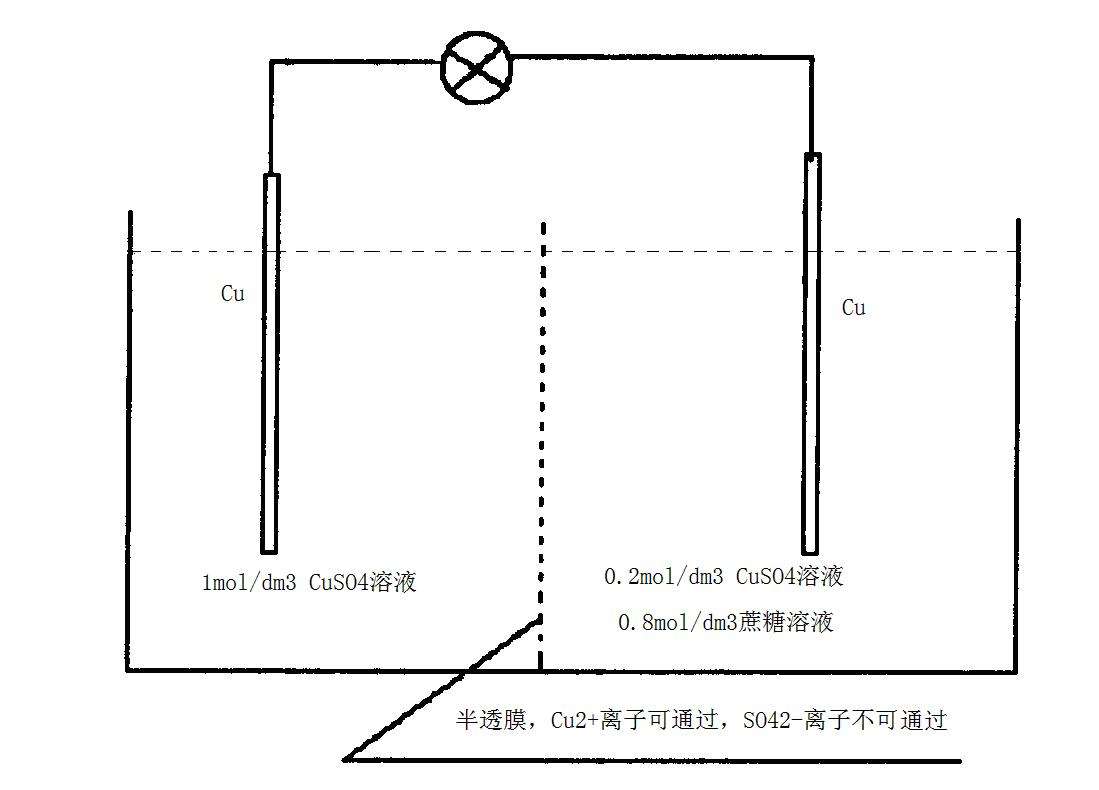
溶液濃差電池

電極濃差電池


液體接界電勢







濃差電池是電化學電池的一種。主要部分包括正、負兩個電極與電解質。一般有電極濃差電池和溶液濃差電池兩類。其電動勢取決於物質的濃度差,是由於一種物質從高濃度狀態向低濃度轉移而產生的。










濃差電池是電化學電池的一種。主要部分包括正、負兩個電極與電解質。一般有電極濃差電池和溶液濃差電池兩類。其電動勢取決於物質的濃度差,是由於一種物質從高...
電動勢是由電池中存在濃度差而產生的電池稱為濃差式電池。濃差式電池又分為兩類:電解質濃度不同形成的濃差式電池,稱為離子濃差電池;另一類是電極濃差電池,...
無遷移濃差電池concen:ratian cell without trari}ference濃差電池的一種,實為兩個電池對接,避免了液接電勢,故是可逆的。...
鹽濃差電池腐蝕 同一金屬的不同部位所接觸的介質的盆濃度不同,形 成盆濃差電池而導致的腐蝕通常,電池「},’j較稀溶液接觸 的部分,因其電極電位較負,成為電池...
中文名稱 濃差腐蝕電池 英文名稱 concentration cor rosion cell 定義 由電極表面附近腐蝕劑之濃度差異引起的電位差而形成的腐蝕電池。 套用學科 機械工程(一級...
海水濃差能指由濃度差形成的化學能。...... 海水濃差能發電 編輯 海水濃度差能發電有滲透壓法、滲析電池法和蒸汽壓差法等幾種不同類型.(l)滲透壓法:利用濃度...
實際上,金屬結構中常出現不同金屬相接觸的情況,在電解液存在的情況下可形成巨觀腐蝕電池。(2)濃差電池同一種金屬浸人不同濃度的電解液中,或者雖在同一電解液中...
電池腐蝕裂隙(濃差電池)瘸蝕 裂隙(濃差電池)腐蝕發生在不同濃度的腐蝕性溶液與同一金屬的不同區域相接觸時。因此,使滯留的溶液能接觸的條件如裂紋、縫隙、鱗皮...
2.2 丁逆電池和可逆電極2.2.1 可逆電池2.2.2 可逆電極2.2.3 可逆電池熱力學2.3 濃差電池2.3.1 離子濃差電池2.3.2 電極濃差電池...
氧濃差電池只適用於控制趨低碳(C<0.03%)鋼的終點,對中、高碳鋼及極低碳鋼(含C在10級),則需要用質譜儀來控制。VOD法工藝流程 編輯 ...
14 魏壽昆 濃差電池快速直接定氧法 分析化學 1974 15 魏壽昆、洪彥若 鎳鋶選擇性氧化的熱力學及動力學 有色金屬 1981 16 魏壽昆 熔鋶及熔融金屬中元素選擇性氧...
但在特殊情況下,因氧氣到達金屬表面的各處有難有易,就會形成濃差電池。例如在金屬重疊面上,即金屬表面與另一金屬表面緊密接觸時,在接觸面的邊緣雖不鏽蝕,但離開...
這是常被討論的差異充氣電池腐蝕的主要一種,儘管是由氧濃差引起的,但真正的腐蝕電池已經不是氧濃差電池了。差異充氣腐蝕總結 編輯 由於氧氣濃度不同並不能導致...
鹼金屬熱電轉換是利用”- Al2O3固體電解質的離子導電性、用鈉作工質,以熱再生濃度差電池過程為工作原理的熱電能量直接轉換新技術。鹼金屬熱電轉換器(Alkali Metal...
由電極反應式:O2 + 2H2O 十 4e-→ 4OH一可得大的部位 也大, 小的部位 亦小,於是就組成了一個氧的濃差電池: 小處的金屬成為陽極,發生氧化反應,被腐蝕; ...
在電解液中,金屬與金屬或金屬與非金屬表面之間構成狹窄的縫隙,縫隙內有關物質的移動受到了阻滯,形成濃差電池,從而產生局部腐蝕,這種腐蝕被稱為縫隙腐蝕。縫隙腐蝕常...
微量氧的分析方法主要有比色法、化學電池法、黃磷發光法、濃差電池法和氣相色譜法。其中比色法是較早採用的分析方法,它是國家標準規定的方法,利用銅氨溶液進行比...
一、氧化鋯探頭。氧化鋯探頭是氧分析器的檢測部件,其核心就是氧化鋯固體電解質氧濃差電池。它的作用是將被測氣體的氧含量轉換成氧濃差電勢。...
第十節濃差電池221一、電極濃差電池221二、電解質濃差電池221第十一節電解222一、電解現象和電解池222二、分解電壓222三、極化和超電勢223...
