金屬熱還原是用金屬 A(或其合金)作還原劑在高溫下將另一種金屬B的化合物還原以製取金屬B(或其合金)的一種方法。金屬熱還原通常是按還原劑來命名。例如,用鋁作還原劑生產金屬鉻,稱為鋁熱法。用矽鐵作還原劑冶煉釩鐵,稱為矽熱法。
基本介紹
- 中文名:金屬熱還原
- 外文名:metallothermic reduction
- 概述:金屬熱還原通常是按還原劑來命名
- 套用範圍:冶金過程
- 學科:冶金工程
- 領域:冶煉
介紹,套用範圍,製備基礎,相關熱力學,熱力學分析,動力學研究,相組成影響,微觀結構影響,機理分析,總結,
介紹
金屬熱還原是用金屬 A(或其合金)作還原劑在高溫下將另一種金屬B的化合物還原以製取金屬B(或其合金)的一種方法。
金屬熱還原通常是按還原劑來命名。例如,用鋁作還原劑生產金屬鉻,稱為鋁熱法:2Al+Cr2O3─→2Cr+Al2O3。鋁熱法生產鉻流程圖如圖1。
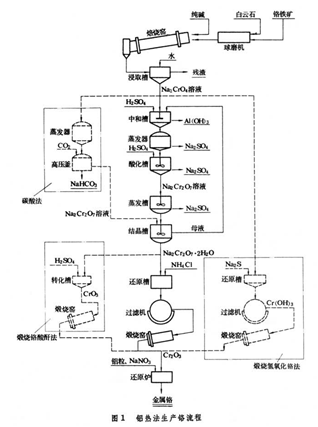
用矽鐵作還原劑冶煉釩鐵,稱為矽熱法:3[Si]+2(V2O3)─→4[V]+3(SiO2)方括弧表示溶於合金中,圓括弧表示溶於渣中。
套用範圍
金屬熱還原廣泛用於冶金過程中,例如:克勞爾(W.J.Kroll)法用鎂熱還原生產海綿鈦;氟化物金屬熱還原法製取稀土金屬;皮吉昂(Pidgeon)法在真空下用矽熱還原煅燒白雲石以生產鎂;用氫化鈣(CaH2)還原二氧化鋯得到氫化鋯,再脫氫以製取電真空鋯粉;以及製取很多種類的金屬和鐵合金。
製備基礎
由Ti−Fe 二元相圖含鈦量為65%~75%的高鈦鐵合金熔點最低為1085℃,易熔化,鈦含量高。 煉鋼時添加高鈦鐵具有添加量少,鋼水中成分易均勻化,偏析少,含鋁、矽、氮等雜質少。用高鈦鐵脫氧的鋼,鑄造組織緻密,鋼的機械性能得以改善。高鈦鐵是冶煉鐵基高溫合金和優質不鏽鋼等不可缺少的材料。目前製備優質高鈦鐵的方法是重熔法,該法在俄羅斯,西歐等已開發國家和地區發展較快。我國主要採用鋁熱法製備高鈦鐵,但是鋁熱法高鈦鐵中氧含量高達5%~10%以上,且Al、Si 等雜質元素含量不達標。儘管近年來發展了很多改進的鋁熱還原工藝,但是高鈦鐵氧含量高,Al、Si殘留質量控制不穩等缺陷始終得不到有效的解決。而且關於鋁熱法研究多集中在操作工藝方式上,針對制約鋁熱法高鈦鐵質量的技術難點及原因研究的很少。例如,四川峨眉鐵合金廠以天然金紅石為原料,採用爐外鋁熱還原法生產高鈦鐵,生產出含鈦73。77%的高鈦鐵,但產品中Al 含量較高,Mn、P、S、C 等含量不穩定。北京有色金屬研究總院通過選用適當的原料,採用爐外鋁熱還原法製得了質量較好的產品,除氧含量外,其餘成分全部達到出口產品的要求。南非Mintek 公司採用直流轉移等離子加熱的鋁熱還原製備高鈦鐵試驗,在隔絕空氣條件下進行反應,可降低產品的氮含量,但不能有效降低產品的氧含量,因此認為一次性還原不可能製取低氧含量的高鈦鐵。紐西蘭也進行了鋁熱還原製備高鈦鐵的研究,以從冶煉釩鈦磁鐵礦獲得的人造鈦鐵礦和鈦屑為原料製備出高鈦鐵。針對制約鋁熱法高鈦鐵的技術難點,對鋁熱法製備高鈦鐵的熱力學,動力學以及合金中氧含量以及夾雜物分布規律等進行系統研究,實現了鋁熱法製備低氧優質高鈦鐵的技術突破。
相關熱力學
Merzhanov 認為反應體系的絕熱溫度大於1800K 的體系才能成為自維持體系,即SHS 過程引發後,反應可以自行維持下去。由絕熱溫度還能判斷SHS 過程中產物相存在狀態。TiO2−Al 體系,Fe2O3−Al 體系,TiO2−Fe2O3−Al,TiO2−Mg 以及Mg−Fe2O3−TiO2 體系的絕熱溫度分別為1805,3135,2410,2067 和3098 K,均大於1800 K 的熱力學判據,說明所有反應均能自我維持發生。用Mg 做還原劑時絕熱溫度更高,因此在配料是加入適量的Mg,有助於提高體系的反應溫度,高的反應溫度為熔煉過程中金渣分離提供了有利條件。同時還原劑中用適量的Mg 粉替代Al 粉,在熔煉過程中生成的MgO 能改善Al2O3 渣的流動性,也為金渣分離創造了有利條件。而且Mg 的還原性更強,生成的MgO屬於鹼性物質,會抑制副反應發生,保證TiO2徹底還原。因此採用Al−Mg 複合還原劑有助於降低傳統鋁熱法高鈦鐵合金中氧含量高,氧化物夾雜過多等缺陷。
熱力學分析
對於Al 還原TiO2 的體系,都是放熱反應,因此反應溫度過高對主反應不利。Al 還原TiO2 生成Ti2O3 最容易,生成TiO 次之;而Al 還原TiO 生成Ti 在熱力學上是最困難的,該反應是鋁熱還原製備高鈦鐵的制約步驟。由於TiO 屬於強鹼性物質,而Al2O3 弱酸性,這將導致Al2O3 與TiO 反應生成副產物。因此,為了保證TiO2 的還原度,必須嚴格控制該副反應的發生。反應溫度對Ti2O3 還原生成TiO、Ti的趨勢影響顯著。添加CaO 能明顯降低反應得吉布斯自由能變,TiO2 還原生成Ti 的趨勢顯著增加,可以有效抑制生成TiO 的副反應發生。添加CaO 可形成鋁酸鈣,降低熔煉渣的黏度,有利於渣金分離,降低高鈦鐵合金中氧化物夾雜等。
Mg 還原TiO2的熱力學規律與Al 還原TiO2 的基本一致,但是由於Mg 具有較高的蒸汽壓,因此高溫時反應的吉布斯自由能變對溫度的變化更敏感,與Al 還原相比,Mg 還原時反應更容易發生。結合絕熱溫度的計算結果可知,採用Al−Mg 合金複合還原劑還原熔煉製備高鈦鐵,對於強化還原程度,降低合金中的氧含量以及控制合金中的夾雜物是有利的。綜上所述,TiO2 的熱還原過程中TiO 是維繫體系平衡的最重要的組元之一,一定程度地降低溫度對Ti2O3→Ti 的反應有利。
動力學研究
由鋁熱法製備高鈦鐵的生產實踐表明,TiO2 的有效還原和金渣有效分離是製備低氧優質高鈦鐵的關鍵。在熱力學分析的基礎上採用DTA 技術系統研究了Al、Mg 還原TiO2 的動力學過程,可知,Al 還原TiO2 起始反應溫度在1010℃附近,屬於液−固反應。反應表觀活化能為164。50 kJ/mol,反應級數為0。414。Mg 還原TiO2 起始反應溫度在506℃附近,屬於氣−固反應。Mg 還原TiO2 的反應起始溫度比Al 還原TiO2 的低很多,這是由於鎂具有較高的蒸汽壓,與熱力學分析結果一致。反應的表觀活化能為383。24 kJ/mol,反應級數為0。59。而Al−Mg 合金還原TiO2 的DTA 曲線上出現了3 個反應峰,573℃放熱峰為Mg 與TiO2 發生還原反應,660℃吸熱峰是鎂鋁、鎂熔化吸熱峰,1244℃的放熱峰為Al 與TiO2 發生還原反應的放熱峰。較之與直接利用Al 還原TiO2 在1010℃左右開始發生還原反應來說,Mg 的添加導致Al 還原TiO2反應滯後,因為Mg 與TiO2 反應生成MgO 阻礙了Al與TiO2 接觸。由熱力學分析知,添加CaO 後熱力學條件更有利,能有效抑制副反應發生,同時能改善渣的流動性,強化金渣分離過程。434℃附近的吸熱峰為Ca(OH)2 脫水反應所致,658℃附近的吸熱峰為Al 熔化吸熱峰,1252℃附近的放熱峰為Al 還原TiO2 放熱反應。Al−TiO2−CaO 體系還原反應的起始溫度滯後,但放熱峰更尖銳,反應進行更容易,與熱力學分析結果一致。反應表觀活化能為93。68 kJ/mol,反應級數為0。008。
相組成影響
鋁還原得到的高鈦鐵合金由Al2O3、TiO2、Ti2O、Fe2TiO4 、Ti9Fe3(Ti0。7Fe0。3)O3 等複雜相組成。Al2O3、TiO2 等存在表明金渣分離並不完全,冶煉動力學條件不充分,同時夾雜物的存在會導致高鈦鐵合金微觀結構缺陷增加。合金還存在TiO2、Ti2O 等物相,表明TiO2 還原不徹底。採用Al−Mg 複合還原劑製備的高鈦鐵合金中氧化物夾雜相明顯減少,說明TiO2 的還原更徹底。氧含量分析結果表明:合金中氧含量降低為3。87%,遠低於現有鋁熱還原的5%~12%的工業水平,對於製備低氧優質高鈦鐵十分有利。因此採用還原能力更強的複合還原劑對降低氧含量和改善合金微觀結構是顯著的。
微觀結構影響
採用Al−10%Mg 合金還原製備的高鈦鐵合金氧存在的區域明顯減少,尤其是鈦基體b 區和鈦鐵共溶體c區,其中已無氧明顯存在。這說明採用Al−10%Mg 做還原劑具有更強的還原能力,此條件下金渣分離效果也更顯著,合金微觀結構更均勻緻密。定氧分析表明,Al 還原製備的高鈦鐵中氧含量高達12。20%,Al−10%Mg 還原製備高鈦鐵中氧含量僅為3。87%,可見TiO2 還原程度得到極大的加強。以上結論與熱力學分析結果一致。
合金中各元素分布並不均勻,特別是Fe 元素只在部分區域內分布,說明熔池內渣金流動性不好;鋁元素含量高的區域,氧元素含量也很高,主要以Al2O3 夾雜物存在的,與XRD 和SEM 電鏡分析結果一致。鐵元素存在的區域鈦的含量也很高,可推測鐵基本以鈦鐵合金的形式存在;矽元素含量高的地方,鈦元素的含量高,而氧元素等含量也較低,推測矽可能是以矽鈦合金形式存在的。
機理分析
鋁熱還原法製備高鈦鐵可分成產熱量大、溫度高(2000℃ 以上) 的反應前期以及熱量小、溫度較低(1800℃以下)反應後期。反應前期熔池沸騰、反應激烈,該階段反應溫度高、化學反應進行的快、高溫合金熔體和熔渣具有很好的流動性,熱還原反應以及渣−金分離基本上在該反應期完成,該階段還原反應的好壞,金渣分離過程好壞直接影響到高鈦鐵合金的質量。反應後期熔池平靜、反應平穩,該階段由於熔池溫度低、熔體流動性差,導致反應前期殘留下來的TiO2 和Al2O3 無法與鈦鐵完全分離,這是高鈦鐵氧化物夾雜多、氧殘留高的根本原因,因此在鋁熱反應前期階段通過強化手段強化TiO2 還原以及金渣分離過程是必要的。在反應後期隨工藝條件的變化會反應生成次生相及形成新的夾雜物。
由於反應後期反應溫度逐漸降低,熔池流動性惡化,新形成的Al2O3 不能有效長大、上浮,就會形成新的Al2O3 夾雜。還原劑不足時,會生成副產物Ti(AlO2)2。熔煉溫度過低,會生成副產物Ti2O,TixOy,Fe2TiO4 導致合金中夾雜物增多,氧含量升高。由於空氣中O2 擴散亦會造成鈦鐵中溶解氧含量和二次氧化。
總結
(1)TiO2−Al,Fe2O3−A,TiO2−Fe2O3−Al,TiO2−Mg以及Mg−Fe2O3−TiO2 體系的絕熱溫度分別為1805,3135,2410,2067 和3098 K,均大於1800 K,說明所有反應均能自發進行。Al 還原TiO2 生成Ti2O3 最容易反應,TiO2 生成TiO 的反應次之,TiO 生成Ti 在熱力學上最為困難,添加CaO 能明顯降低吉布斯自由能變。Mg還原TiO2 與Al 還原的規律相似,反應更易發生。
(2)Al 還原TiO2 的反應的表觀活化能為164。50kJ/mol,反應級數為0。414。添加CaO會導致Al 還原TiO2反應滯後,反應表觀活化能為93。68 kJ/mol,反應級數為0。008。Mg 還原TiO2 的表觀活化能為383。235 kJ/mol,反應級數為0。591。Al−Mg還原TiO2在573℃發生的反應為Mg 還原TiO2,活化能為404。01 kJ/mol,反應級數為0。584;在1244℃的放熱峰位為Al 還原峰,活化能為208。083 kJ/mol,反應級數為0。166。
(3)Al 還原製備的高鈦鐵合金主要由合金由Al2O3、TiO2、Ti2O、Fe2TiO4 、Ti9Fe3(Ti0。7Fe0。3)O3 等相組成,其中存在大量氧化物夾雜,微觀結構差,氧含量高達12。20%。採用Al−Mg 複合還原劑有助於降低合金中氧含量以及夾雜物含量,改善合金的微觀結構,合金中氧含量僅為3。87%。

