簡介
光譜項是所有元素所發射的光譜線的波數總由兩項之差決定。即
,式中m、n為整數,T(m)、T(n)稱為光譜項,其函式形式隨不同原子而異。例如:氫原子光譜中巴爾末線系的兩個光譜項分別為
和
。原子光譜的這一普遍公式稱作里茲併合原則。1900年瑞典物理學家裡德伯(1854~1919年)及1908年裡茲分別發現很多元素的光譜都有這種關係,並提出光譜項的概念。併合原則的發現和光譜項概念的提出使光譜研究由光譜線轉向光譜項。但當時對其物理意義並不清楚。玻爾理論提出後,才賦予光譜項以明確的物理意義,即每一光譜項與原子的一定能級相對應,兩光譜項之差與兩定態能量之差相聯繫。按玻爾理論得氫原子的光譜項
。光譜項的分立性闡明了光譜線的分立性。
光譜項圖和光譜項符號
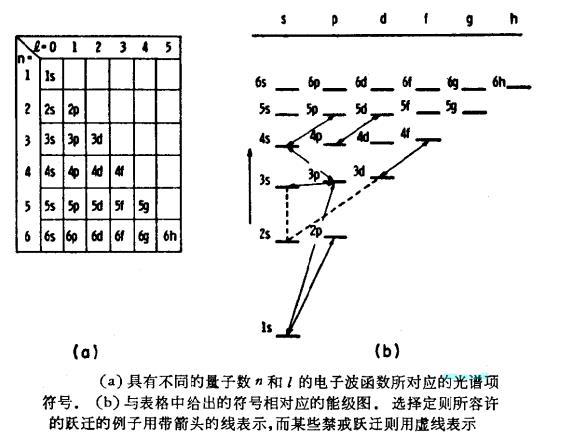
按早期對譜線系分類的傳統,已經確定了用符號表示單個電子軌道的如下方法:用一個數字和它後面的一個字母作為符號,分別表示主量子數n和角量子數l。字母島s,p,d,f…
分別代表l==0,1,2,3…(最初它們表示鹼金屬光譜的銳線系,主線系,漫線系和基線系)。因此,最低的一些光譜項符號如下面左圖所示。例如,3d電子是在n=3和l=2的軌道上的。
這些光譜項對應的能量值習慣上在一些n增加的系列中示出,每一個系列具有一個不變的角量子數l。最低的一些量子數決定最低的一些能量值;因此,表格的垂直順序和下面右圖所示的光譜項圖是相反的。
原子光譜項
原子狀態由L、S、J和mJ規定,原子光譜和原子磁性質實驗指出,L、S和J不同的原子狀態,其能量有所差別。這正反映了原子的軌道角動量、自旋角動量和總角動量的不同,表明電子的相互作用情況的不同,其中包括電子之間的電磁相互作用的不同,因此量子數L、S、J規定了原子整體能級。
在光譜上常把具有總軌道角動量量子數L,總自旋量子數S的一組原子狀態稱為光譜項,並用如下符號表示:
當L=0,1,2,3…數值時,分別用S、P、D、F…標記。將2S+1的數值寫在L的左上角,自然知道了2S+1,也就知道了S。在大多數情況下,S和L的數值對能級的影響較大,J值對能級影響較小,常常不考慮J值,稱
為光譜項。有時需要將J值寫在L的右下角,定義為光譜支項。
對於給定的J,mJ所取的數值有2J+1個,故每一個光譜支項還包括2J+1個狀態,當忽略自旋和軌道相互作用時,這些狀態均屬於同一能級,但當存在外磁場時,總角動量在Z軸方向有2J+1個不同取向,從而分裂成更細的2J+1個能級,這就是塞曼效應。
(2S+1)叫光譜的多重性,當S=0,2S+1=1稱為單重態,當S=1,2S+1=3,稱為三重態。例如s叫做單重S態,P叫做三重P態等等。
通過以上討論看出,光譜項反映了原子量子數和原子能級之間的關係。由洪特規則可確定能級最低的譜項。用光譜項語言敘述洪特規則如下。
i)s最大者能級最低,若s相同,則L最大者能級最低。這一規律叫做洪特第一規則;
ii)若S和L都相同,則對於半充滿前的組態(如P,P或d,d,d,d)導出的光譜支項而言,J愈小能級愈低;而對於半充滿後的組態(如p,p,p或d,d,d,d,d)導出的光譜支項而言,J愈大能級愈低。這一規律叫做洪特第二規則。
例如氫原子基態(1s),因l=L=0,S=J=1/2,故基態對應的光譜項和光譜支項為S,S1/2。
氦原子的基態為(1s),因為l1=l2=0,因兩電子必須自旋相反,使得S=0,所以對應的光譜項為S,光譜支項為S0(J=0)。
對於原子的一個電子組態有幾個光譜項或光譜支項時,在寫光譜項(或光譜支項)時,通常總是把能量高的譜項放在前面。
光譜項意義
愛因斯坦光子假說認為,光能量是以光子的形式輻射的,而每個光子的能量是
。根據能量守恆定律,原子輻射一個光子,其能量就減少
,如果原子初狀態的能量為E
A,輻射一個光子後的末狀態的能量為E
B,則
由上式可見,表示譜線的兩個光譜項,分別與原子的初狀態能量和末狀態能量相對應。所以,光譜項實際上是原子狀態能量的反映。
於是,我們可以從光譜項的性質對原子能量狀態的性質作一些推測。由上述式子可知,光譜項是一系列不連續的分立數值,因此原子狀態能量也應是一系列不連續的分立數值。原子各個狀態的能量,像台階一樣,形成不連續的序列,這種性質就稱為原子能量狀態的量子化,而每一個能量台階,都稱為原子的
能級。原子只能處於由一個能級所代表的穩定狀態上,這些穩定狀態都稱為定態。原子的每一條光譜線,都必須由兩個光譜項的差來表示,而不能用一個光譜項來表示,這說明原子處於任何一個能級上都不會輻射能量,而只有當它從一個能級躍遷到另一個能級的過程中才吸收或輻射能量。