氰化溴,又名溴化氰,溴氰等。主要用於有機合成、鍊金、制殺蟲劑等。毒作用似氫氰酸,氰化氫,氰化鈉,並有明顯刺激性。吸入後引起頭痛、頭暈、噁心、嘔吐、虛弱、驚厥、昏迷、咳嗽、呼吸困難,重者發生肺水腫,可致死。對眼和皮膚有強烈刺激性。另外,對於環境亦有很強的危害。
基本介紹
- 中文名:氰化溴
- 英文名:Cyanogen bromide
- 別稱:溴化氰
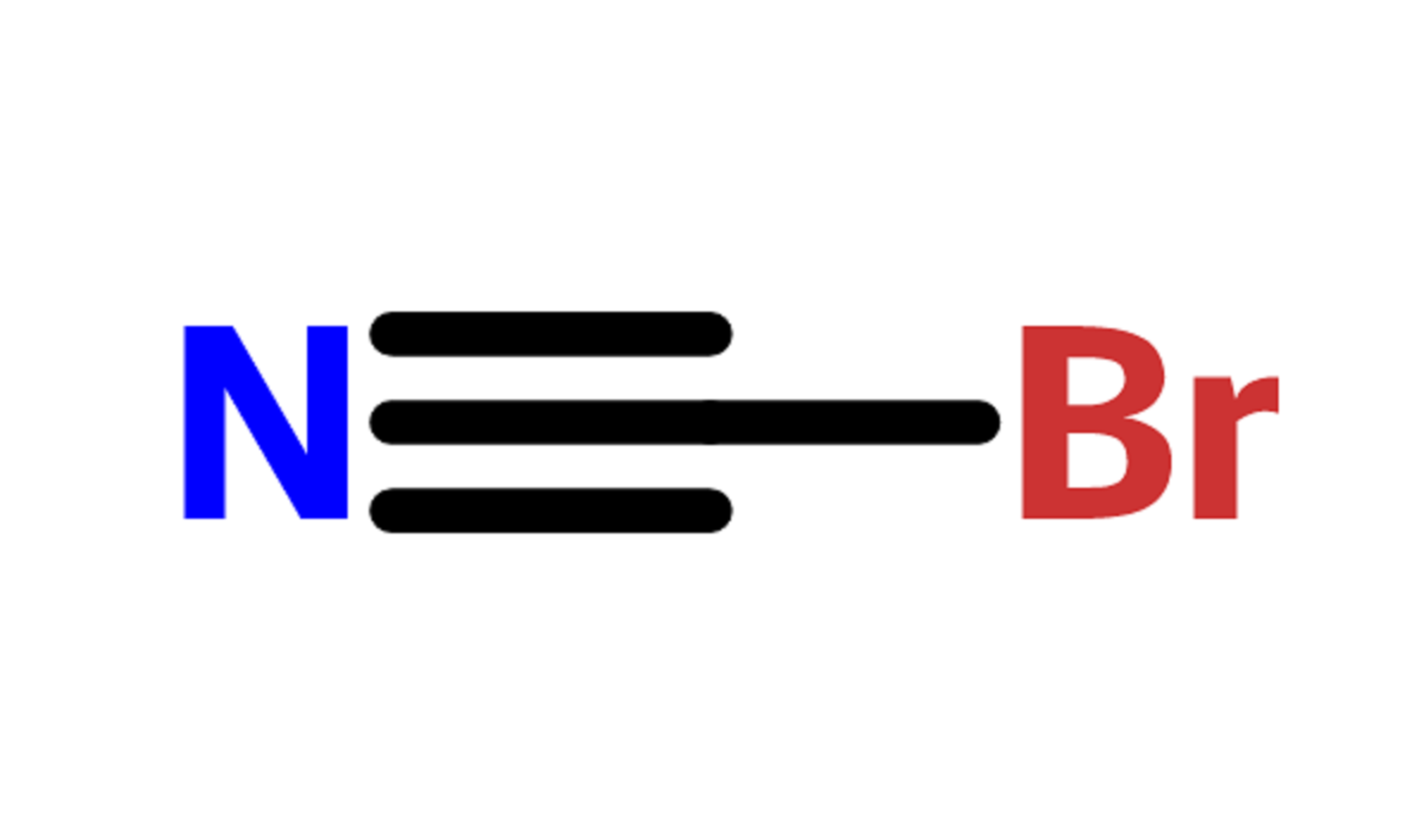
- 化學式:BrCN
- 分子量:105.93
- CAS登錄號:506-68-3
- EINECS登錄號:208-051-2
- 密度:2.02
- 危險性符號:R34 R26/27/28 R50/53
- 危險品運輸編號:UN 1889 6.1/PG 1
物性數據,分子結構數據,計算化學數據,性質與穩定性,合成方法,貯存方法,用途,溴化氰活化,
物性數據
1.性狀:無色或白色針狀或立方形結晶,常溫下揮發。
2.熔點(℃):52。
3.沸點(℃):61.4。
4.相對密度(水=1):2.02(20℃)。
5.相對蒸氣密度(空氣=1):3.65。
6.飽和蒸氣壓(kPa):13.33(23℃)。
7.辛醇/水分配係數:-0.29。
8.溶解性:溶於水,易溶於乙醇、乙醚,溶於苯。
分子結構數據
1、摩爾折射率:14.32。
2、摩爾體積(cm3/mol):51.6。
3、等張比容(90.2K):132.3。
4、表面張力(dyne/cm):43.2。
5、極化率(10-24cm3):5.67。
計算化學數據
1、疏水參數計算參考值(XlogP):1.1
2、氫鍵供體數量:0
3、氫鍵受體數量:1
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:23.8
7、重原子數量:3
8、表面電荷:0
9、複雜度:31.3
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:1
性質與穩定性
1.具有強烈的吸濕性,對空氣和濕氣敏感,遇水會發生激烈反應放出氫氣。
2.穩定性:穩定。
3.禁配物:強氧化劑、鹼類。
4.避免接觸的條件:受熱、水蒸氣。
5.聚合危害:聚合。
6.分解產物:溴化氫、氰化氫。
合成方法
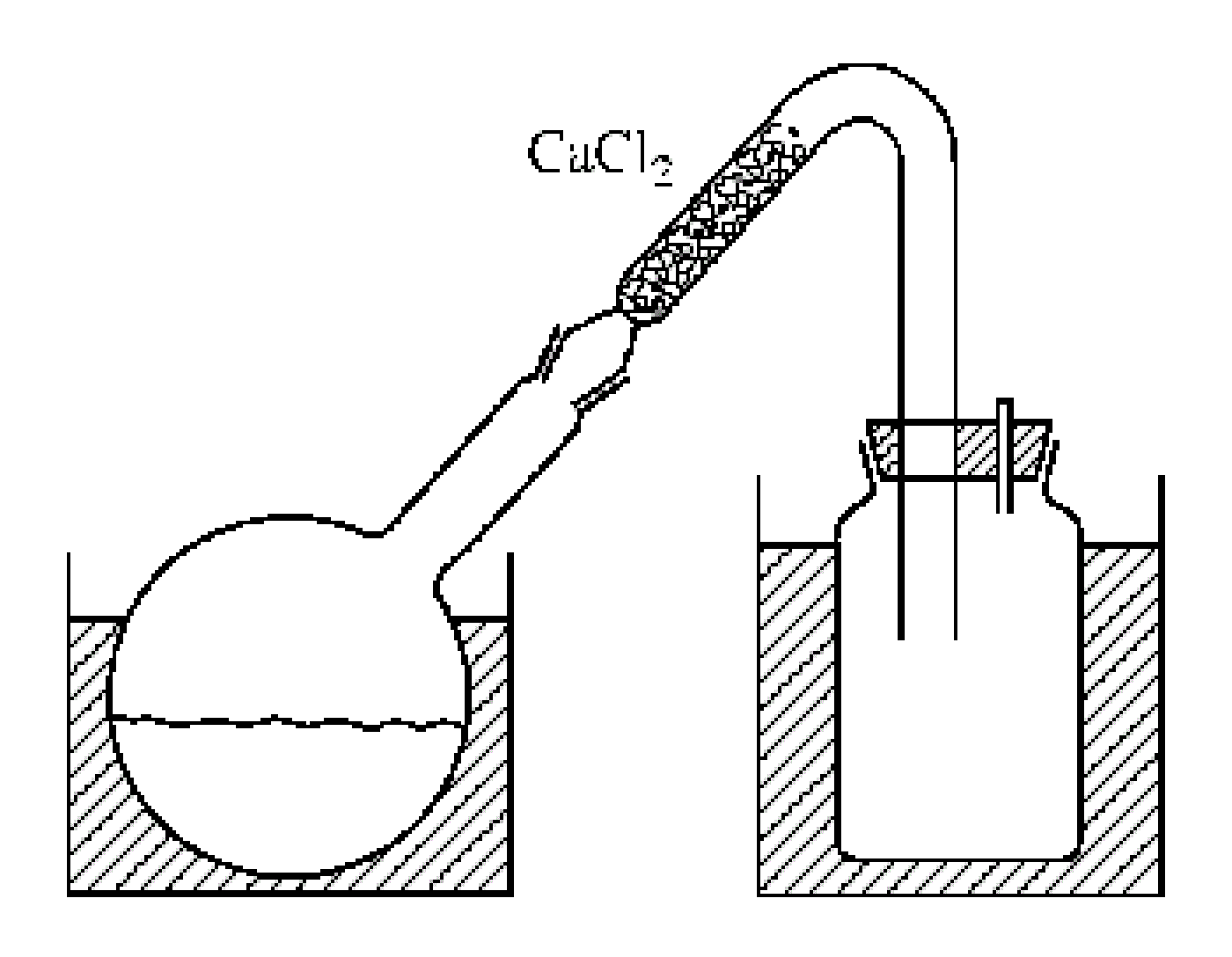
1、製備溴化氰的裝置如下圖,在抽氣良好的通風櫥中將500g溴(160mL)裝在一個用冰鹽冷卻劑冷卻的IL磨口瓶中。加50mL水覆蓋在溴上。在激烈攪拌下170g NaCN溶於1200mL水的溶液以每秒1滴的速度滴入。反應混合物的溫度保持在20℃以下。要避免氰化物局部過量生成(CN)x。將最後的150mL NaCN溶液用水稀釋至原體積的2倍,繼續加溶液,每加一次要猛烈搖盪燒瓶。一旦搖盪時出現不再消失的棕色,即可棄去其餘NaCN溶液(加NaCN約需5h)。把一個彎成V形的粗玻璃管裝在圓底燒瓶上(如圖)。在較短臂裝顆粒狀CaCl2,在水浴上將CNBr蒸出。產物聚集在作接受器用的廣口瓶中,呈雪白的結晶,590g,按溴計產率90%。
2、通過氰化鈉或丙烯腈和溴製備而成。
貯存方法
儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。包裝要求密封,不可與空氣接觸。應與氧化劑、鹼類、食用化學品分開存放,切忌混儲。不宜大量儲存或久存。儲存應備有合適的材料收容泄漏物。
用途
1、溴化氰是一種常用的氰化試劑,在氰化反應領域,用途十分廣泛,可以合成大量的氰化物。利用它也可以方便地生成多種具有生物活性的物質,諸如脲、硫脲、硒脲、胍鹽、羥基胍鹽和其它大量的雜環化合物等。
2、用於有機合成、鍊金、制殺蟲劑等。
溴化氰活化
溴化氰活化法是常用的活化方法之一,活化過程主要是生成亞胺碳酸活性基團,它可以和伯氨基(NH2)反應,主要生成異脲衍生物。
溴化氰活化的基質可以在溫和的條件下與配體結合,結合的配體量大。利用溴化氰活化的基質通過進一步處理還可以得到很多其它的衍生物。這種方法的缺點是溴化氰活化法的基質和配體偶聯後生成的異脲衍生物中氨基的pKa=10.4,所以通常會帶一定的正電荷,從而使基質可能有陰離子離子交換作用,增大了非特異性吸附,影響親和層析的解析度。另外溴化氰活化的基質與配體結合不夠穩定,尤其是當與小配體結合時,可能會出現配體脫落現象。另外溴化氰有劇毒、易揮發,所以操作不便。