基本介紹
- 中文名:標準摩爾生成焓
- 外文名:Standard Enthalpy Change of Formation
- 套用學科:熱化學
- 別稱:標準摩爾生成熱
定義
性質
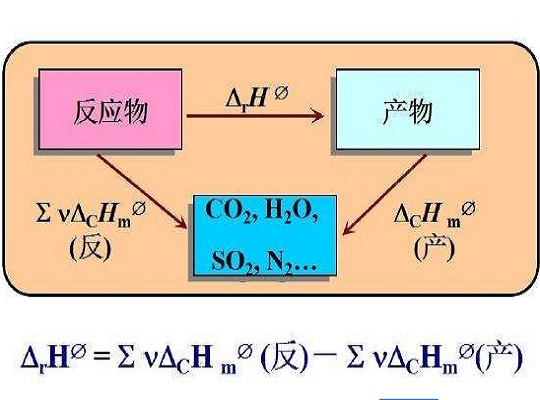
套用
物態 | 分子式 | ΔHf0 in kJ/mol | |
氨 | aq | NH3 | -80 |
氨 | g | NH3 | -46.1 |
碳(石墨) | s | C | 0 |
碳(金剛石) | s | C | +1.987 |
碳 | g | C | +718.9 |
一氧化碳 | g | CO | -110.53 |
二氧化碳 | g | CO2 | -393.51 |
二氧化碳 | aq | CO2 | -413.8 |
s | Na2CO3 | -1131 | |
氯化鈉(食鹽) | aq | NaCl | -407 |
氯化鈉(食鹽) | s | NaCl | -411,12 |
氯化鈉(食鹽) | l | NaCl | -385,92 |
氯化鈉(食鹽) | g | NaCl | -181,42 |
氫氧化鈉 | aq | NaOH | -469,6 |
氫氧化鈉 | s | NaOH | -426,7 |
aq | NaNO3 | -446,2 | |
s | NaNO3 | -424,8 | |
二氧化硫 | g | SO2 | -297 |
l | CS2 | +87,9 | |
g | CS2 | +115,3 | |
硫酸 | l | H2SO4 | -814 |
二氧化矽 | s | SiO2 | -911 |
g | NO2 | 33 | |
g | NO | 90 | |
水 | l | H2O | -286 |
水 | g | H2O | -242 |
氫 | g | H2 | 0 |
氟 | g | F2 | 0 |
氯 | g | Cl2 | 0 |
溴 | l | Br2 | 0 |
溴 | g | Br2 | +31 |
碘 | s | I2 | 0 |
碘 | g | I2 | +62 |
物態 | 分子式 | ΔHf0 in kJ/mol | |
甲烷 | g | CH4 | -75 |
g | C2H6 | -85 | |
g | C3H8 | -104 | |
甲醛 | g | HCHO | -116 |
g | CH3CHO | -166 | |
g | C2H5CHO | -197 | |
甲醇 | l | CH3OH | -239 |
甲醇 | g | CH3OH | -201 |
乙醇(酒精) | l | C2H5OH | -278 |
乙醇(酒精) | g | C2H5OH | -235 |
正丙醇(1-丙醇) | l | C3H7OH | -305 |
正丙醇(1-丙醇) | g | C3H7OH | -258 |
甲酸(蟻酸) | l | HCOOH | -409,5 |
甲酸(蟻酸) | g | HCOOH | -363 |
甲酸(蟻酸) | aq | HCOOH | -410.3 |
乙酸 (醋酸) | l | CH3COOH | -487 |
乙酸 (醋酸) | g | CH3COOH | -435 |
丙酸 | l | C2H5COOH | -511 |