基本介紹
- 中文名:標準摩爾燃燒焓
- 外文名:Standard Enthalpy Change of Combustion
- 學科屬性:物理,化學
簡介
焓
標準摩爾生成焓
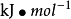
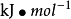
標準摩爾燃燒焓是指一摩爾物質在標準狀況下完全燃燒時的反應焓變,其單位為kJ/mol,具體定義請參見正文。...
標準燃燒熱是在標態及TK條件下以確定的穩定產物的焓值為0反應物的相對焓值。...... 1mol物質完全燃燒時的反應熱 全稱 標準摩爾燃燒熱 學科 化學目錄 1 定義 ...
在標準狀態即壓力為100kPa,一定溫度(一般是298.15K)下時,由元素最穩定的單質生成生成1mol純化合物時的反應熱稱為該化合物的標準摩爾生成焓(standard enthalpy of...
標準摩爾反應焓變是指參加反應的各物質都處於標準態時的反應焓變。熱力學是無機化學課程的重要組成部分,它是以熱力學第一定律、熱力學第二定律、熱力學第三定律為...
標準摩爾生成焓與標準摩爾燃燒焓=生成焓計算中的優點 編輯 套用燃燒焓計算熱效應時,往往遇到由較大的數值差減以獲得較小的數值,這樣必然會引入較大的誤差,因此...
標準摩爾反應焓變是指參加反應的各物質都處於標準態時的反應焓變。焓變計算是解決等壓情況下反應中能量轉化問題、進行吉布斯自由能變變計算進而判斷反應進行程度和方...
化學熱力學規定,某溫度下,由處於標準狀態下的各種元素的指定單質,生成標準狀態下的1mol某純物質的熱效應,叫做該溫度下該物質的標準摩爾生成熱。或簡稱標準生成熱。...
本實驗用已知標準摩爾燃燒焓的苯甲酸[ΔCHm(苯甲酸,s,298.15K)= -3226.71kJ/mol]來測定量熱計的熱容量K,Ql= -6.699J·cm。重複實驗,測定萘的摩爾燃燒...
1.燃燒熱是以1 mol可燃物作為標準來進行測定的,因此在計算燃燒熱時,熱化學...·mol-1 這時的分數是代表摩爾數(即為參加反應的物質的量)而不是分子個數,...
那么與標準摩爾生成焓一樣,可規定一套相對數值以計算體系的自由能改變數。標準摩爾生成自由能,一般是指標準摩爾生成吉布斯自由能,意為在規定溫度(T)和標準壓力p下...
在一定溫度和壓力下,由最穩定的單質生成1摩爾純物質的熱效應多稱生成焓,因為此生成反應的熱效應等於該過程體系焓的增量。標準狀態下(各單質與生成的純物質皆處於...
標準摩爾燃燒焓是指在標準壓力100kPa和指定溫度(一般為298.15K)時下,一摩爾物質完全燃燒時的反應焓變,簡稱燃燒焓。用符號ΔcHΘm表示,下標c代表燃燒(combustion),...
由於熱力學不能定義自由焓的絕對數值,所以實際套用時,可以利用它是狀態函式的性質來計算物質的標準生成自由焓,全名為“標準摩爾生成自由焓”。首先,需要設定參考狀態...
這也是可以利用蓋斯定律和標準摩爾燃燒焓的定義來證明的。即反應熱等於所有參與反應的物質在該狀態下的標準摩爾燃燒焓與該物質在化學方程式中的化學計量係數的乘積的...
在一定溫度和壓力下,由最穩定的單質生成1摩爾純物質的熱效應。現在多稱生成焓,因為此生成反應的熱效應等於該過程體系焓的增量。標準狀態下(各單質與生成的純物質...
在等溫度過程中,體系吸的熱因過程不同,有反應熱(如生成熱、燃燒熱、分解熱與...離子的生成熱,為此,必須建立一個相對標準,習慣上規定H+(∞,aq)的標準摩爾生成...
