愛斯萬(替吉奧膠囊),適應症為不能切除的局部晚期或轉移性胃癌。
基本介紹
- 藥品名稱:愛斯萬
- 藥品類型:處方藥、醫保工傷用藥
警示語,成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,生產企業,委託企業,核准日期,修訂日期,
警示語
警告:
1. 本藥僅可用於適合使用替吉奧膠囊與順鉑聯合化療的胃癌患者。患者須在具備急救設施的醫院就診、並在有豐富腫瘤化療經驗的醫生指導下使用。在決定使用替吉奧膠囊化療方案前,應仔細閱讀合併用藥的說明書。在化療開始前,須向患者詳細解釋療效和風險,並取得患者本人或其監護人的知情同意。
2. 與傳統的口服氟尿嘧啶類藥物不同,替吉奧膠囊的劑量限制毒性(DLT)是骨髓抑制(詳見【不良反應】),須經常進行實驗室檢查,並嚴密觀察檢查結果。
3.本藥有可能導致重度肝功能異常,如暴發性肝炎,須定期檢查肝功能並嚴密觀察,以便儘早發現肝功能異常。若發現早期肝功能異常或乏力伴隨食慾減退等症狀,須嚴密觀察。若發現黃疸(鞏膜黃染),須立即停藥,並採取相應措施。
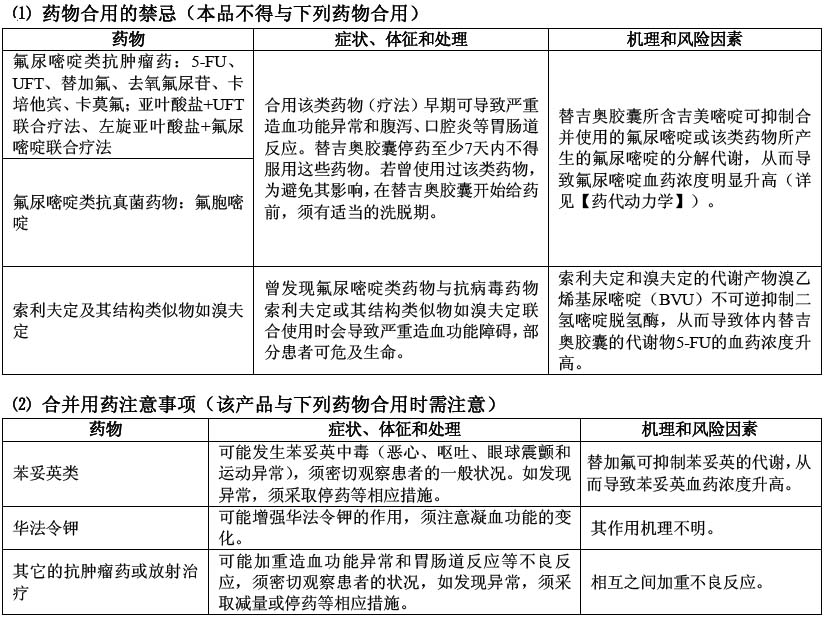
4. 本藥不得與其它氟尿嘧啶類抗腫瘤藥、含氟尿嘧啶類藥物的化療方案[如亞葉酸鹽/替加氟-尿嘧啶(UFT)聯合化療]、抗真菌藥氟胞嘧啶等合用,可能導致嚴重造血功能障礙等不良反應(見【藥物相互作用】)。
5. 本藥不得與索利夫定或溴夫定等抗病毒藥合用,可能導致嚴重造血功能障礙等不良反應,部分患者可危及生命(詳見【藥物相互作用】)。
6. 使用本藥前須仔細閱讀本說明書並嚴格遵守【用法用量】的規定。
1. 本藥僅可用於適合使用替吉奧膠囊與順鉑聯合化療的胃癌患者。患者須在具備急救設施的醫院就診、並在有豐富腫瘤化療經驗的醫生指導下使用。在決定使用替吉奧膠囊化療方案前,應仔細閱讀合併用藥的說明書。在化療開始前,須向患者詳細解釋療效和風險,並取得患者本人或其監護人的知情同意。
2. 與傳統的口服氟尿嘧啶類藥物不同,替吉奧膠囊的劑量限制毒性(DLT)是骨髓抑制(詳見【不良反應】),須經常進行實驗室檢查,並嚴密觀察檢查結果。
3.本藥有可能導致重度肝功能異常,如暴發性肝炎,須定期檢查肝功能並嚴密觀察,以便儘早發現肝功能異常。若發現早期肝功能異常或乏力伴隨食慾減退等症狀,須嚴密觀察。若發現黃疸(鞏膜黃染),須立即停藥,並採取相應措施。
4. 本藥不得與其它氟尿嘧啶類抗腫瘤藥、含氟尿嘧啶類藥物的化療方案[如亞葉酸鹽/替加氟-尿嘧啶(UFT)聯合化療]、抗真菌藥氟胞嘧啶等合用,可能導致嚴重造血功能障礙等不良反應(見【藥物相互作用】)。
5. 本藥不得與索利夫定或溴夫定等抗病毒藥合用,可能導致嚴重造血功能障礙等不良反應,部分患者可危及生命(詳見【藥物相互作用】)。
6. 使用本藥前須仔細閱讀本說明書並嚴格遵守【用法用量】的規定。
成份
本品為複方製劑,每粒膠囊含:
20mg規格:替加氟20mg,吉美嘧啶5.8mg,奧替拉西鉀19.6mg。
25mg規格:替加氟25mg,吉美嘧啶7.25mg,奧替拉西鉀24.5mg。
20mg規格:替加氟20mg,吉美嘧啶5.8mg,奧替拉西鉀19.6mg。
25mg規格:替加氟25mg,吉美嘧啶7.25mg,奧替拉西鉀24.5mg。
性狀
本品20mg規格為不透明、內含白色粉末和顆粒的硬膠囊,有白色膠囊帽和白色膠囊體。
本品25mg規格為不透明、內含白色粉末和顆粒的硬膠囊,有橙色膠囊帽和白色膠囊體。
本品25mg規格為不透明、內含白色粉末和顆粒的硬膠囊,有橙色膠囊帽和白色膠囊體。
適應症
不能切除的局部晚期或轉移性胃癌。
規格
(1)20mg (2)25mg
用法用量
替吉奧膠囊用於聯合順鉑治療不能切除的局部晚期或轉移性胃癌。
一般情況下,根據體表面積按照下表決定成人的首次劑量。用法為每日2次、早晚餐後口服,連續給藥28天,休息14天,為一個治療周期。給藥直至患者病情惡化或無法耐受為止。
體表面積(㎡)首次劑量(按替加氟計)
<1.25 每次40mg
≥1.25-<1.5每次50mg
≥1.5每次60mg
可根據患者情況增減給藥量。每次給藥量按40mg、50mg、60mg、75mg四個劑量等級順序遞增或遞減。若未見本藥所導致的實驗室檢查(血常規、肝腎功能)異常和胃腸道症狀等安全性問題,且醫師判斷有必要增量時,則可按照上述順序增加一個劑量等級,上限為75mg/次。如需減量,則按照劑量等級遞減,下限為40mg/次。連續口服21天、休息14天,給藥第8天靜脈滴注順鉑60mg/m[sup]2[/sup],為一個治療周期。給藥直至患者病情惡化或無法耐受為止。
用法用量的注意事項:
1. 可根據患者情況,參照下述標準增減給藥量。
減量 首次劑量 增量
停藥 每次40mg 每次50mg
每次40mg→停藥 每次50mg 每次60mg
每次50mg→每次40mg→停藥 每次60mg 每次75mg
每個周期內增量不得超過一個劑量等級。
2. 若需縮短化療間期,須確認無本藥所導致的實驗室檢查(血常規、肝腎功能)異常和胃腸道症狀等安全性問題,但化療間期不得少於7天。不能手術或復發性乳腺癌患者縮短化療間期的安全性尚未得到證實(無臨床用藥經驗)。
3. 為避免骨髓抑制和暴發性肝炎等嚴重不良反應,每次化療開始前須進行實驗室檢查(血常規和肝腎功能)、全面觀察患者的狀況,化療期間至少每2周進行1次檢查。如發現任何異常,必須採取相應措施,如延長化療間期、按上述規定減量或停藥。第一治療周期或增量時更須密切觀察和檢查(詳見【臨床研究】)。
4. 基礎研究(大鼠)發現空腹服藥可改變奧替拉西鉀的生物利用度,導致其對氟尿嘧啶磷酸化的抑制作用減弱,從而降低本藥的抗腫瘤作用,故須餐後服用。
患者使用注意事項:
患者用藥時應注意:
本藥為鋁塑泡罩包裝(PTP),應告知患者服藥前需將藥物由泡罩中壓出。曾有報導患者誤將鋁箔板服下,導致食道穿孔,引起嚴重併發症如縱膈炎。
一般情況下,根據體表面積按照下表決定成人的首次劑量。用法為每日2次、早晚餐後口服,連續給藥28天,休息14天,為一個治療周期。給藥直至患者病情惡化或無法耐受為止。
體表面積(㎡)首次劑量(按替加氟計)
<1.25 每次40mg
≥1.25-<1.5每次50mg
≥1.5每次60mg
可根據患者情況增減給藥量。每次給藥量按40mg、50mg、60mg、75mg四個劑量等級順序遞增或遞減。若未見本藥所導致的實驗室檢查(血常規、肝腎功能)異常和胃腸道症狀等安全性問題,且醫師判斷有必要增量時,則可按照上述順序增加一個劑量等級,上限為75mg/次。如需減量,則按照劑量等級遞減,下限為40mg/次。連續口服21天、休息14天,給藥第8天靜脈滴注順鉑60mg/m[sup]2[/sup],為一個治療周期。給藥直至患者病情惡化或無法耐受為止。
用法用量的注意事項:
1. 可根據患者情況,參照下述標準增減給藥量。
減量 首次劑量 增量
停藥 每次40mg 每次50mg
每次40mg→停藥 每次50mg 每次60mg
每次50mg→每次40mg→停藥 每次60mg 每次75mg
每個周期內增量不得超過一個劑量等級。
2. 若需縮短化療間期,須確認無本藥所導致的實驗室檢查(血常規、肝腎功能)異常和胃腸道症狀等安全性問題,但化療間期不得少於7天。不能手術或復發性乳腺癌患者縮短化療間期的安全性尚未得到證實(無臨床用藥經驗)。
3. 為避免骨髓抑制和暴發性肝炎等嚴重不良反應,每次化療開始前須進行實驗室檢查(血常規和肝腎功能)、全面觀察患者的狀況,化療期間至少每2周進行1次檢查。如發現任何異常,必須採取相應措施,如延長化療間期、按上述規定減量或停藥。第一治療周期或增量時更須密切觀察和檢查(詳見【臨床研究】)。
4. 基礎研究(大鼠)發現空腹服藥可改變奧替拉西鉀的生物利用度,導致其對氟尿嘧啶磷酸化的抑制作用減弱,從而降低本藥的抗腫瘤作用,故須餐後服用。
患者使用注意事項:
患者用藥時應注意:
本藥為鋁塑泡罩包裝(PTP),應告知患者服藥前需將藥物由泡罩中壓出。曾有報導患者誤將鋁箔板服下,導致食道穿孔,引起嚴重併發症如縱膈炎。
不良反應
一、國外臨床試驗
1. 聯合治療
在日本進行的以晚期胃癌患者為對象、比較替吉奧膠囊單藥(連續28天口服替吉奧膠囊40~60mg/次,每日2次,休息14天)和替吉奧膠囊聯合順鉑(連續21天口服替吉奧膠囊40~60mg/次,每日2次,第8天時給予60mg/m[sup]2[/sup]順鉑)治療的多中心Ⅲ期隨機對照試驗,298例可評估不良反應的患者的主要不良反應如下表所示。
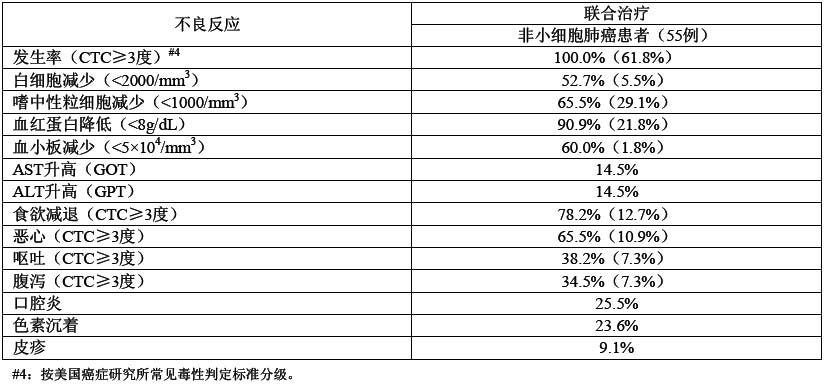
非小細胞肺癌聯合化療(連續21天口服替吉奧膠囊,第8天時給予60mg/m[sup]2[/sup]順鉑)的晚Ⅱ期臨床試驗發現,可評價不良反應的55例患者均發生不良反應,其主要不良反應如下表所示。
2. 單藥治療
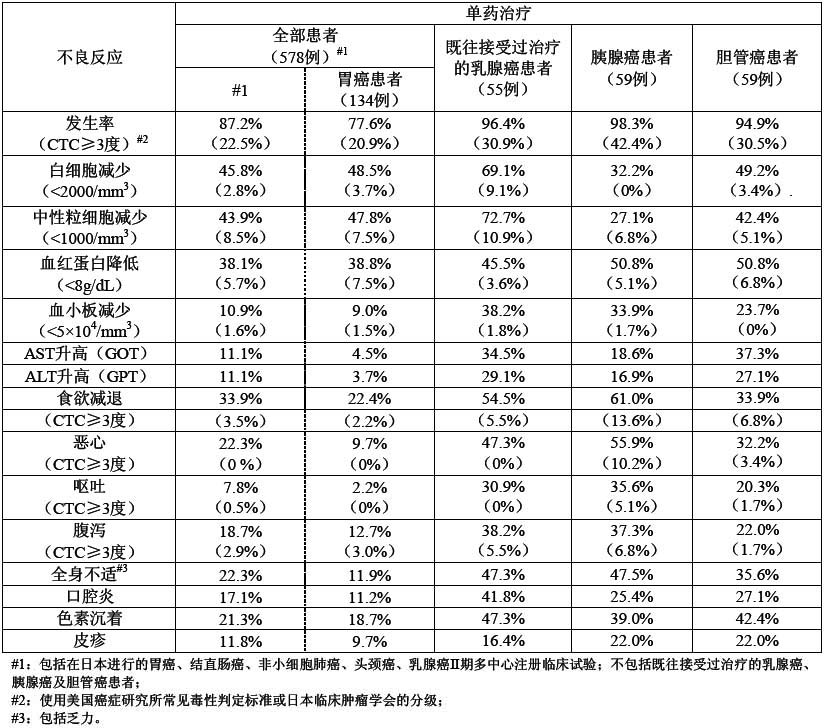
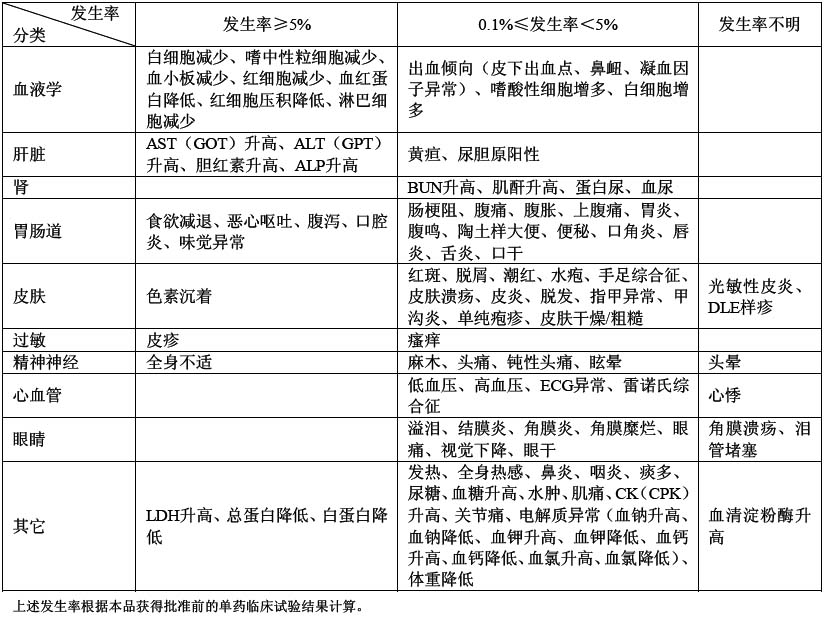
在可評估不良反應的578例患者中(不包括下述既往接受過治療的乳腺癌、胰腺癌和膽管癌患者),不良反應發生率為87.2%(504例)。與其它類型腫瘤相比,既往接受過紫杉醇治療的不能手術或復發的乳腺癌、胰腺癌和膽管癌患者的不良反應發生率較高,分別為96.4%、98.3%和94.9%。胰腺癌患者不良反應發生率較高,食慾減退、噁心、嘔吐和腹瀉等胃腸道反應尤為明顯。單藥使用時,常見以下不良反應:
3. 不良反應的發生時間和恢復時間
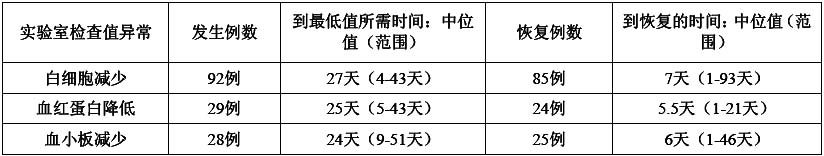
分析替吉奧膠囊治療胃癌、結直腸癌、頭頸癌、非小細胞肺癌(單藥治療)、不能手術或復發性乳腺癌、胰腺癌以及膽管癌晚Ⅱ期臨床試驗入選的453例患者的不良反應發生時間,其結果如下。
在整個周期中,從給藥開始到白細胞計數[3000/mm[sup]3[/sup]、血紅蛋白[8g/dL、血小板計數[7.5×10[sup]4[/sup]/mm[sup]3[/sup]的最低值所需時間中位值分別為27天、25天和24天;其中確認恢復至上述標準以上者的所需時間中位值分別為7天、5.5天和6天。
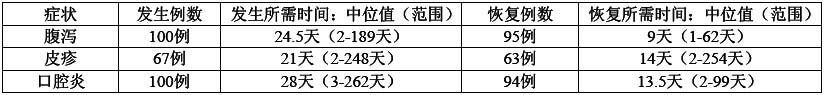
與本藥有關的腹瀉、皮疹和口腔炎等不良反應從首次給藥開始至發生不良反應所需時間的中位值分別為24.5天、21天和28天;上述不良反應從最嚴重等級到恢復正常所需時間中位值分別為9天、14天和13.5天。
4. 腎功能異常患者的不良反應
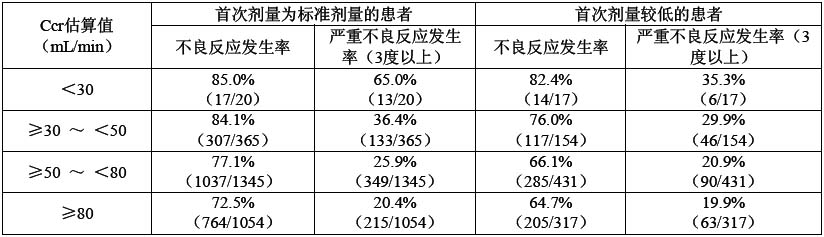
上市後1年內的藥品套用情況(胃癌)分析,根據性別、年齡、體重、血清肌酐值等用Cockcroft-Gault公式計算的肌酐清除率(Ccr估算值)分組,其不良反應發生率如下表所示。不良反應發生率隨肌酐清除率下降而上升,同時不良反應嚴重程度升高。與首次給藥採用標準劑量的患者相比,用量較低(比標準劑量低一個等級)者的不良反應發生率較低。
Cockcroft-Gault公式:
5. 重要不良反應
1) 骨髓抑制、溶血性貧血:可能發生重度骨髓抑制如全血細胞減少、粒細胞減少(症狀:發熱、咽痛和全身不適)、白細胞減少、貧血及血小板減少(發生率如上)和溶血性貧血(發生率不明),須密切觀察。如發現異常,須採取停藥等必要措施。
2) 彌散性血管內凝血(DIC):因可能出現DIC(0.4%),應密切注意患者狀況。如血小板計數、血清FDP和血漿纖維蛋白原等血液學檢查發現異常,須停藥並採取必要措施。
3) 暴發性肝炎等嚴重肝功能異常(發生率不明)(詳見【警告】)。
4) 脫水:可能因嚴重腹瀉導致脫水(發生率不明),須密切觀察。如發現異常,須停藥並採取補液等相應措施。
5) 重度腸炎:可能發生重度腸炎(0.5%),須密切觀察。若發生嚴重腹痛、腹瀉等症狀,須停藥並採取相應措施。
6)[sup]*[/sup] 間質性肺炎:可能發生間質性肺炎(0.3%)(早期症狀:咳嗽、氣短、呼吸困難和發熱),須密切觀察。如發現異常,須停藥並進行胸部X光檢查和給予腎上腺皮質激素等相應措施。
7)心肌梗死、心絞痛、心律失常、心力衰竭:可能發生心肌梗死、心絞痛、心律失常(包括實性心動過速)及心力衰竭(發生率均不明),須密切觀察。如發現胸痛、昏厥、心悸、心電圖異常、呼吸困難等症狀,須停藥並採取相應措施。
8) 重度口腔炎、消化道潰瘍、消化道出血和消化道穿孔:可能發生嚴重的口腔炎(發生率不明)、消化道潰瘍(0.5%)、消化道出血(0.3%)和消化道穿孔(發生率不明),須密切觀察。如發現異常,須停藥,根據需要進行腹部X光等檢查,並採取相應措施。
9) 急性腎功能衰竭:可能發生嚴重的腎臟疾病如急性腎功能衰竭(發生率不明),須密切觀察。如發現異常,須停藥並採取相應措施。
10) Steven-Johnson綜合徵和中毒性表皮壞死症(Lyell綜合徵):可能會發生Steven-Johnson綜合徵和中毒性表皮壞死症(發生率不明),須密切觀察。如發現異常,須停藥並採取相應措施。
11)腦白質病等神經精神系統異常:可能發生腦白質病(主要症狀為意識障礙、小腦共濟失調和痴呆樣症狀等)、意識障礙、定向力障礙、嗜睡、記憶減退、錐體外系症狀、語言障礙、四肢癱瘓、步態障礙、尿失禁或感覺障礙(發生率均不明),應密切觀察。若出現上述症狀,須停藥。
12) 急性胰腺炎:可能出現急性胰腺炎(發生率不明),應密切觀察。如果出現腹痛或血清澱粉酶升高,須停藥並採取相應措施。
13) 橫紋肌溶解症:可能出現橫紋肌溶解症(發生率不明),症狀包括肌肉痛、虛弱、CK升高和血/尿肌紅蛋白升高,須停藥並採取相應措施,並注意防止橫紋肌溶解所導致的急性腎功能衰竭。
14) 嗅覺喪失:可能發生嗅覺障礙(0.1%)、嗅覺喪失(發生率不明),須密切觀察。如發現異常,須停藥並採取相應措施。
[sup]*[/sup] 對非小細胞肺癌患者進行了間質性肺炎和其他肺部疾病發生率的研究。
藥物上市後在非小細胞肺癌的用藥研究表明間質性肺炎的發生率為0.7%(11/1669),其它肺部疾病包括放射性肺炎、呼吸困難和呼吸衰竭的發生率為0.7%(12/1669)。
6. 其它不良反應
可能發生下列不良反應,如發現異常,須採取減量或停藥等相應措施。如發現藥物過敏,須停藥並採取相應措施。
既往接受過治療的乳腺癌患者的手足綜合徵發生率較高(21.8%)。本藥上市後臨床研究發現,不能切除或復發的胃癌患者的溢淚發生率較高(16.0%)。
7. 不良反應注意事項
⑴ 曾報告接受替吉奧膠囊治療的患者出現急性白血病(個別病例伴隨白血病前期)或骨髓增生異常綜合徵(MDS)。
⑵ 有極少數患者缺乏氟尿嘧啶代謝酶——二氫嘧啶脫氫酶(DPD),若使用氟尿嘧啶類藥物,則在給藥初期可能出現嚴重不良反應(如口腔炎、腹瀉、造血功能異常和神經系統疾病)。
⑶ 曾發現腦梗死,但與替吉奧膠囊的因果關係並不確定。
⑷ 奧替拉西鉀在強酸環境下易分解(犬),而奧替拉西鉀的濃度降低可減弱其抑制消化道不良反應的作用(大鼠),故胃pH值明顯降低時有可能導致腹瀉。
⑸ 犬反覆給藥後曾發現球結膜鞏膜色素沉著和角膜雲翳。
二、國內臨床試驗
在中國進行的胃癌臨床試驗中,可評估不良反應的230例患者所出現的不良反應均是在日本報告的已知不良反應,與日本進行的臨床試驗中的替吉奧聯合順鉑組和替吉奧單藥組的安全性結果基本無差異,未發現新的嚴重不良反應。CTC≥3度的不良反應發生率如下:
替吉奧聯合順鉑組的血液學不良反應包括:貧血5.3%、粒細胞減少5.3%、紅細胞壓積降低2.6%、血紅蛋白降低10.5%、淋巴細胞減少 5.3%、嗜中性粒細胞減少 17.1%、血小板減少 6.6%、紅細胞減少 2.6%、白細胞減少 13.2%、AST升高 1.3%、LDH升高 1.3%、BUN升高 1.3%;非血液學不良反應包括:腹瀉 6.6%、噁心 2.6%、嘔吐 6.6%、腸炎 1.3%、肝功能異常 2.6%、過敏 1.3%、肺部感染1.3%。
替吉奧單藥組的血液學不良反應包括:貧血2.5%、血紅蛋白降低6.3%、淋巴細胞減少8.8%、嗜中性粒細胞減少3.8%、白細胞減少1.3%、中性粒細胞增多1.3%、白細胞增多1.3%、ALP升高1.3%、低鉀血症1.3%、肌酸激酶升高1.3%;非血液學不良反應包括:腹瀉3.8%、腸炎1.3%、嘔吐1.3%、食慾下降2.5%、四肢水腫1.3%。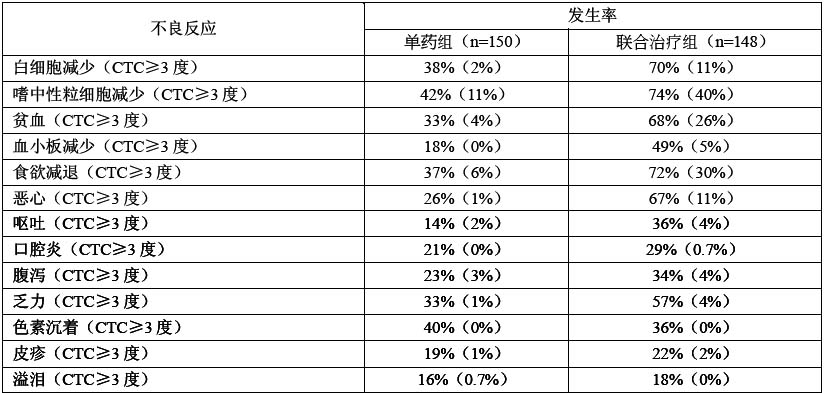

1. 聯合治療
在日本進行的以晚期胃癌患者為對象、比較替吉奧膠囊單藥(連續28天口服替吉奧膠囊40~60mg/次,每日2次,休息14天)和替吉奧膠囊聯合順鉑(連續21天口服替吉奧膠囊40~60mg/次,每日2次,第8天時給予60mg/m[sup]2[/sup]順鉑)治療的多中心Ⅲ期隨機對照試驗,298例可評估不良反應的患者的主要不良反應如下表所示。
非小細胞肺癌聯合化療(連續21天口服替吉奧膠囊,第8天時給予60mg/m[sup]2[/sup]順鉑)的晚Ⅱ期臨床試驗發現,可評價不良反應的55例患者均發生不良反應,其主要不良反應如下表所示。
2. 單藥治療
在可評估不良反應的578例患者中(不包括下述既往接受過治療的乳腺癌、胰腺癌和膽管癌患者),不良反應發生率為87.2%(504例)。與其它類型腫瘤相比,既往接受過紫杉醇治療的不能手術或復發的乳腺癌、胰腺癌和膽管癌患者的不良反應發生率較高,分別為96.4%、98.3%和94.9%。胰腺癌患者不良反應發生率較高,食慾減退、噁心、嘔吐和腹瀉等胃腸道反應尤為明顯。單藥使用時,常見以下不良反應:
3. 不良反應的發生時間和恢復時間
分析替吉奧膠囊治療胃癌、結直腸癌、頭頸癌、非小細胞肺癌(單藥治療)、不能手術或復發性乳腺癌、胰腺癌以及膽管癌晚Ⅱ期臨床試驗入選的453例患者的不良反應發生時間,其結果如下。
在整個周期中,從給藥開始到白細胞計數[3000/mm[sup]3[/sup]、血紅蛋白[8g/dL、血小板計數[7.5×10[sup]4[/sup]/mm[sup]3[/sup]的最低值所需時間中位值分別為27天、25天和24天;其中確認恢復至上述標準以上者的所需時間中位值分別為7天、5.5天和6天。
與本藥有關的腹瀉、皮疹和口腔炎等不良反應從首次給藥開始至發生不良反應所需時間的中位值分別為24.5天、21天和28天;上述不良反應從最嚴重等級到恢復正常所需時間中位值分別為9天、14天和13.5天。
4. 腎功能異常患者的不良反應
上市後1年內的藥品套用情況(胃癌)分析,根據性別、年齡、體重、血清肌酐值等用Cockcroft-Gault公式計算的肌酐清除率(Ccr估算值)分組,其不良反應發生率如下表所示。不良反應發生率隨肌酐清除率下降而上升,同時不良反應嚴重程度升高。與首次給藥採用標準劑量的患者相比,用量較低(比標準劑量低一個等級)者的不良反應發生率較低。
Cockcroft-Gault公式:
5. 重要不良反應
1) 骨髓抑制、溶血性貧血:可能發生重度骨髓抑制如全血細胞減少、粒細胞減少(症狀:發熱、咽痛和全身不適)、白細胞減少、貧血及血小板減少(發生率如上)和溶血性貧血(發生率不明),須密切觀察。如發現異常,須採取停藥等必要措施。
2) 彌散性血管內凝血(DIC):因可能出現DIC(0.4%),應密切注意患者狀況。如血小板計數、血清FDP和血漿纖維蛋白原等血液學檢查發現異常,須停藥並採取必要措施。
3) 暴發性肝炎等嚴重肝功能異常(發生率不明)(詳見【警告】)。
4) 脫水:可能因嚴重腹瀉導致脫水(發生率不明),須密切觀察。如發現異常,須停藥並採取補液等相應措施。
5) 重度腸炎:可能發生重度腸炎(0.5%),須密切觀察。若發生嚴重腹痛、腹瀉等症狀,須停藥並採取相應措施。
6)[sup]*[/sup] 間質性肺炎:可能發生間質性肺炎(0.3%)(早期症狀:咳嗽、氣短、呼吸困難和發熱),須密切觀察。如發現異常,須停藥並進行胸部X光檢查和給予腎上腺皮質激素等相應措施。
7)心肌梗死、心絞痛、心律失常、心力衰竭:可能發生心肌梗死、心絞痛、心律失常(包括實性心動過速)及心力衰竭(發生率均不明),須密切觀察。如發現胸痛、昏厥、心悸、心電圖異常、呼吸困難等症狀,須停藥並採取相應措施。
8) 重度口腔炎、消化道潰瘍、消化道出血和消化道穿孔:可能發生嚴重的口腔炎(發生率不明)、消化道潰瘍(0.5%)、消化道出血(0.3%)和消化道穿孔(發生率不明),須密切觀察。如發現異常,須停藥,根據需要進行腹部X光等檢查,並採取相應措施。
9) 急性腎功能衰竭:可能發生嚴重的腎臟疾病如急性腎功能衰竭(發生率不明),須密切觀察。如發現異常,須停藥並採取相應措施。
10) Steven-Johnson綜合徵和中毒性表皮壞死症(Lyell綜合徵):可能會發生Steven-Johnson綜合徵和中毒性表皮壞死症(發生率不明),須密切觀察。如發現異常,須停藥並採取相應措施。
11)腦白質病等神經精神系統異常:可能發生腦白質病(主要症狀為意識障礙、小腦共濟失調和痴呆樣症狀等)、意識障礙、定向力障礙、嗜睡、記憶減退、錐體外系症狀、語言障礙、四肢癱瘓、步態障礙、尿失禁或感覺障礙(發生率均不明),應密切觀察。若出現上述症狀,須停藥。
12) 急性胰腺炎:可能出現急性胰腺炎(發生率不明),應密切觀察。如果出現腹痛或血清澱粉酶升高,須停藥並採取相應措施。
13) 橫紋肌溶解症:可能出現橫紋肌溶解症(發生率不明),症狀包括肌肉痛、虛弱、CK升高和血/尿肌紅蛋白升高,須停藥並採取相應措施,並注意防止橫紋肌溶解所導致的急性腎功能衰竭。
14) 嗅覺喪失:可能發生嗅覺障礙(0.1%)、嗅覺喪失(發生率不明),須密切觀察。如發現異常,須停藥並採取相應措施。
[sup]*[/sup] 對非小細胞肺癌患者進行了間質性肺炎和其他肺部疾病發生率的研究。
藥物上市後在非小細胞肺癌的用藥研究表明間質性肺炎的發生率為0.7%(11/1669),其它肺部疾病包括放射性肺炎、呼吸困難和呼吸衰竭的發生率為0.7%(12/1669)。
6. 其它不良反應
可能發生下列不良反應,如發現異常,須採取減量或停藥等相應措施。如發現藥物過敏,須停藥並採取相應措施。
既往接受過治療的乳腺癌患者的手足綜合徵發生率較高(21.8%)。本藥上市後臨床研究發現,不能切除或復發的胃癌患者的溢淚發生率較高(16.0%)。
7. 不良反應注意事項
⑴ 曾報告接受替吉奧膠囊治療的患者出現急性白血病(個別病例伴隨白血病前期)或骨髓增生異常綜合徵(MDS)。
⑵ 有極少數患者缺乏氟尿嘧啶代謝酶——二氫嘧啶脫氫酶(DPD),若使用氟尿嘧啶類藥物,則在給藥初期可能出現嚴重不良反應(如口腔炎、腹瀉、造血功能異常和神經系統疾病)。
⑶ 曾發現腦梗死,但與替吉奧膠囊的因果關係並不確定。
⑷ 奧替拉西鉀在強酸環境下易分解(犬),而奧替拉西鉀的濃度降低可減弱其抑制消化道不良反應的作用(大鼠),故胃pH值明顯降低時有可能導致腹瀉。
⑸ 犬反覆給藥後曾發現球結膜鞏膜色素沉著和角膜雲翳。
二、國內臨床試驗
在中國進行的胃癌臨床試驗中,可評估不良反應的230例患者所出現的不良反應均是在日本報告的已知不良反應,與日本進行的臨床試驗中的替吉奧聯合順鉑組和替吉奧單藥組的安全性結果基本無差異,未發現新的嚴重不良反應。CTC≥3度的不良反應發生率如下:
替吉奧聯合順鉑組的血液學不良反應包括:貧血5.3%、粒細胞減少5.3%、紅細胞壓積降低2.6%、血紅蛋白降低10.5%、淋巴細胞減少 5.3%、嗜中性粒細胞減少 17.1%、血小板減少 6.6%、紅細胞減少 2.6%、白細胞減少 13.2%、AST升高 1.3%、LDH升高 1.3%、BUN升高 1.3%;非血液學不良反應包括:腹瀉 6.6%、噁心 2.6%、嘔吐 6.6%、腸炎 1.3%、肝功能異常 2.6%、過敏 1.3%、肺部感染1.3%。
替吉奧單藥組的血液學不良反應包括:貧血2.5%、血紅蛋白降低6.3%、淋巴細胞減少8.8%、嗜中性粒細胞減少3.8%、白細胞減少1.3%、中性粒細胞增多1.3%、白細胞增多1.3%、ALP升高1.3%、低鉀血症1.3%、肌酸激酶升高1.3%;非血液學不良反應包括:腹瀉3.8%、腸炎1.3%、嘔吐1.3%、食慾下降2.5%、四肢水腫1.3%。








禁忌
1. 對替吉奧膠囊的組成成份有嚴重過敏史的患者禁用。
2. 重度骨髓抑制的患者禁用(可能會加重骨髓抑制)。
3. 重度腎功能異常的患者禁用[因5-FU分解代謝酶抑制劑——吉美嘧啶經尿排泄明顯降低時可能導致5-FU的血藥濃度升高,從而加重骨髓抑制等不良反應(詳見【藥代動力學】)。
4. 重度肝功能異常的患者禁用(可能會加重肝功能異常)。
5. 正在接受其它氟尿嘧啶類抗腫瘤藥治療(包括聯合治療)的患者禁用(詳見【藥物相互作用】)。
6. 正在接受氟胞嘧啶治療的患者禁用(詳見【藥物相互作用】)。
7. 正在接受索利夫定及其結構類似物(溴夫定)治療的患者禁用(詳見【藥物相互作用】)。
8. 妊娠或有可能妊娠的婦女禁用(詳見【孕婦及哺乳期婦女用藥】)
2. 重度骨髓抑制的患者禁用(可能會加重骨髓抑制)。
3. 重度腎功能異常的患者禁用[因5-FU分解代謝酶抑制劑——吉美嘧啶經尿排泄明顯降低時可能導致5-FU的血藥濃度升高,從而加重骨髓抑制等不良反應(詳見【藥代動力學】)。
4. 重度肝功能異常的患者禁用(可能會加重肝功能異常)。
5. 正在接受其它氟尿嘧啶類抗腫瘤藥治療(包括聯合治療)的患者禁用(詳見【藥物相互作用】)。
6. 正在接受氟胞嘧啶治療的患者禁用(詳見【藥物相互作用】)。
7. 正在接受索利夫定及其結構類似物(溴夫定)治療的患者禁用(詳見【藥物相互作用】)。
8. 妊娠或有可能妊娠的婦女禁用(詳見【孕婦及哺乳期婦女用藥】)
注意事項
1. 慎用[下列患者應慎用替吉奧膠囊]
⑴ 有骨髓抑制的患者[可能會加重骨髓抑制];
⑵ 腎功能異常的患者[因5-FU分解代謝酶抑制劑——吉美嘧啶經尿排泄明顯降低時可能導致5-FU的血液濃度升高,從而加重骨髓抑制等不良反應(詳見【藥代動力學】)];
⑶ 有肝功能異常的患者[可能會加重肝功能異常];
⑷ 有感染性疾病的患者[感染性疾病可能會因骨髓抑制而加重];
⑸ 糖耐量異常的患者[可能會加重糖耐量異常];
⑹ 有間質性肺炎或間質性肺炎病史的患者[可能導致症狀加重或病情進展];
⑺ 有心臟病或心臟病病史的患者[可能會加重症狀];
⑻ 有消化道潰瘍或出血的患者[可能會加重症狀];
⑼ 老年患者(詳見【老年用藥】)。
2. 重要的注意事項
⑴ 替吉奧膠囊停藥後,如需要服用其它的氟尿嘧啶類抗腫瘤藥或氟胞嘧啶抗真菌藥,必須有至少7天的洗脫期(詳見【藥物相互作用】)。
⑵ 其它的氟尿嘧啶類抗腫瘤藥或氟胞嘧啶抗真菌藥停用後,考慮到之前藥物的影響,如使用替吉奧膠囊,必須有適當的洗脫期(詳見【藥物相互作用】)。
⑶ 有報告顯示,氟尿嘧啶類藥物與抗病毒藥物索利夫定或溴夫定聯合使用時會產生嚴重造血功能障礙,可能危及患者生命。所以不要與索利夫定及其結構類似物聯合使用。索利夫定及其結構類似物停藥後,考慮到之前藥物的影響,在使用替吉奧膠囊前必須有至少56天的洗脫期(詳見【藥物相互作用】)。
⑷ 曾報告了由骨髓抑制產生的嚴重感染性疾病(敗血症)導致患者因感染性休克和彌散性血管內凝血而死亡的案例,故應特別注意避免感染或出血傾向的出現或加重。
⑸ 妊娠婦女使用需要考慮到潛在的性腺影響。
⑹ 本品可能會引發或加重間質性肺炎,重者可致死。因此在給予替吉奧膠囊前,要對患者進行檢查以確定是否患有間質性肺炎。給藥期間應密切觀察患者呼吸、咳嗽和有無發熱等症狀,同時進行胸部X光檢查。如發現異常,則立即停藥,並採取相應措施。非小細胞肺癌患者比其它癌症患者更容易發生間質性肺炎等肺部疾病(詳見【不良反應】)。
⑴ 有骨髓抑制的患者[可能會加重骨髓抑制];
⑵ 腎功能異常的患者[因5-FU分解代謝酶抑制劑——吉美嘧啶經尿排泄明顯降低時可能導致5-FU的血液濃度升高,從而加重骨髓抑制等不良反應(詳見【藥代動力學】)];
⑶ 有肝功能異常的患者[可能會加重肝功能異常];
⑷ 有感染性疾病的患者[感染性疾病可能會因骨髓抑制而加重];
⑸ 糖耐量異常的患者[可能會加重糖耐量異常];
⑹ 有間質性肺炎或間質性肺炎病史的患者[可能導致症狀加重或病情進展];
⑺ 有心臟病或心臟病病史的患者[可能會加重症狀];
⑻ 有消化道潰瘍或出血的患者[可能會加重症狀];
⑼ 老年患者(詳見【老年用藥】)。
2. 重要的注意事項
⑴ 替吉奧膠囊停藥後,如需要服用其它的氟尿嘧啶類抗腫瘤藥或氟胞嘧啶抗真菌藥,必須有至少7天的洗脫期(詳見【藥物相互作用】)。
⑵ 其它的氟尿嘧啶類抗腫瘤藥或氟胞嘧啶抗真菌藥停用後,考慮到之前藥物的影響,如使用替吉奧膠囊,必須有適當的洗脫期(詳見【藥物相互作用】)。
⑶ 有報告顯示,氟尿嘧啶類藥物與抗病毒藥物索利夫定或溴夫定聯合使用時會產生嚴重造血功能障礙,可能危及患者生命。所以不要與索利夫定及其結構類似物聯合使用。索利夫定及其結構類似物停藥後,考慮到之前藥物的影響,在使用替吉奧膠囊前必須有至少56天的洗脫期(詳見【藥物相互作用】)。
⑷ 曾報告了由骨髓抑制產生的嚴重感染性疾病(敗血症)導致患者因感染性休克和彌散性血管內凝血而死亡的案例,故應特別注意避免感染或出血傾向的出現或加重。
⑸ 妊娠婦女使用需要考慮到潛在的性腺影響。
⑹ 本品可能會引發或加重間質性肺炎,重者可致死。因此在給予替吉奧膠囊前,要對患者進行檢查以確定是否患有間質性肺炎。給藥期間應密切觀察患者呼吸、咳嗽和有無發熱等症狀,同時進行胸部X光檢查。如發現異常,則立即停藥,並採取相應措施。非小細胞肺癌患者比其它癌症患者更容易發生間質性肺炎等肺部疾病(詳見【不良反應】)。
孕婦及哺乳期婦女用藥
⑴ 妊娠或可能妊娠的婦女禁用替吉奧膠囊。[妊娠婦女服用UFT後曾發生新生兒畸形。另外,動物試驗也曾發現致畸作用(妊娠大鼠和家兔連續口服替吉奧膠囊(相當於替加氟7mg/kg和1.5mg/kg)發現胎兒內臟異常、骨骼異常和骨化延遲)]。
⑵ 哺乳期婦女服用替吉奧膠囊時應停止哺乳[尚無臨床資料,但動物(大鼠)試驗發現替吉奧膠囊可經乳汁排泄]。
⑵ 哺乳期婦女服用替吉奧膠囊時應停止哺乳[尚無臨床資料,但動物(大鼠)試驗發現替吉奧膠囊可經乳汁排泄]。
兒童用藥
低體重出生兒、新生兒、嬰兒、幼兒和兒童使用替吉奧膠囊的安全性尚未得到驗證[尚無臨床資料。如兒童必須使用替吉奧膠囊,須考慮其對性腺的影響,特別注意不良反應的發生]。
老年用藥
由於老年人的生理功能下降,須慎重使用本藥。
藥物相互作用
藥物過量
尚無相關資料。
臨床試驗
⑴ 聯合治療
SPIRITS試驗:在一項以305例日本晚期胃癌患者為對象,比較替吉奧膠囊單藥(以下簡稱單藥組,連續28天口服替吉奧膠囊40~60mg/次,每日2次,每6周重複)和替吉奧膠囊聯合順鉑治療(以下簡稱聯合治療組,連續21天口服替吉奧膠囊40~60mg/次,每日2次,第8天給予順鉑60mg/m[sup]2[/sup],每5周重複)的多中心Ⅲ期隨機對照試驗中,主要終點指標為總生存期(OS),次要指標為無進展生存時間(PFS)和腫瘤緩解率。兩組的患者基線特徵是均衡可比。在分析的298例患者中,聯合治療組(148例)和單藥組(150例)中位生存時間分別為13個月和11個月,組間總生存期Hazard比為0.77(95%置信區間0.61-0.98,Log-rank檢驗p=0.04),與單藥組相比,聯合治療可降低死亡風險約23%;兩組中位PFS分別為6個月和4個月,Hazard比為0.57(95%置信區間0.44-0.73,Log-rank檢驗p[0.0001),與對照組相比,本品/順鉑聯合化療可降低復發風險約43%。另外在193例可評價靶病灶病例中,聯合治療組和單藥組的客觀緩解率分別為54%(95%置信區間43-65%)和31%(95%置信區間23-41%;Fisher檢驗,p=0.002)。
SC-101試驗:一項由中國15個研究中心參加的隨機對照多中心臨床研究,230例晚期胃癌患者隨機分為替吉奧單藥組(以下簡稱單藥組,80例,連續28天口服替吉奧膠囊40~60mg/次,每日2次,每6周重複)、替吉奧聯合順鉑組(以下簡稱聯合治療組,76例,連續21天口服替吉奧膠囊40~60mg/次,每日2次,第8天給予順鉑60mg/m[sup]2[/sup],每5周重複)和氟尿嘧啶聯合順鉑組(以下簡稱對照組,74例,氟尿嘧啶600mg/m[sup]2[/sup]/日靜脈輸注,順鉑20mg/m[sup]2[/sup]/日,靜滴30分鐘,第1~5天給藥,每4周重複)。所有患者均需堅持給藥,直至腫瘤進展或無法耐受。其中對照組治療失敗患者可繼續使用替吉奧單藥進行二線治療。主要觀察指標為腫瘤緩解率,次要指標為總生存期(OS)和治療失敗時間(TTF)。三組患者的基線人口特徵均衡可比。獨立療效評價委員會對影像學資料按照RECIST標準進行評價,結果顯示,在224例患者中,聯合治療組(74例)、單藥組(77例)和對照組(73例)腫瘤緩解率分別為37.8%、24.7%和19.2%,聯合治療組顯著優於對照組(CMH檢驗,p=0.021);對照組治療失敗後有41例患者接受了替吉奧單藥二線治療,腫瘤緩解率為14.6%。聯合治療組、單藥組和對照組的中位OS分別為433天、267天、309天(對照組生存期含41例治療失敗後轉至替吉奧單藥二線治療病例),聯合治療組顯著優於對照組(Log-rank檢驗,p=0.038)和單藥組(Log-rank檢驗,p<0.001);中位TTF分別為159天、126天和85天,聯合治療組顯著優於對照組(Log-rank,p<0.001)和單藥組(Log-rank,p=0.008)。
⑵ 單藥治療
總結口服替吉奧膠囊(每日80-150mg,按替加氟計)每日2次的臨床試驗結果,胃癌有效率為46.5%(60/129)。該結果包括在日本進行的以消化道腫瘤為對象的本品單藥化療早Ⅱ期試驗和以胃癌為對象的2項晚Ⅱ期臨床試驗。各試驗詳細情況如下。
早Ⅱ期試驗:以晚期胃癌為對象,連續28天口服替吉奧膠囊50-75mg/次,每日2次,每6周重複,給藥2周期以上。共入選31例,可評價療效病例28例(其中復治患者9例),客觀緩解率為53.6%(15/28、90%置信區間38.4-68.1%)。
晚Ⅱ期臨床試驗(胃癌T試驗):以晚期胃癌患者為對象,連續28天口服替吉奧膠囊40~60mg/次,每日2次,每6周重複。共入選51例,均為可評價療效病例(包括原發病灶評價病例),其中完全緩解1例、部分緩解24例,客觀緩解率49%(25/51、95%置信區間35.9-62.3%)。
晚Ⅱ期臨床試驗(胃癌K試驗):以晚期胃癌患者為對象,連續28天口服替吉奧膠囊40~60mg/次,每日2次,每6周重複。共入選51例,其中可評價療效病例50例(包括原發病灶評價病例),其中部分緩解20例,客觀緩解率40.0%(20/50、95%置信區間30.4-58.9%)。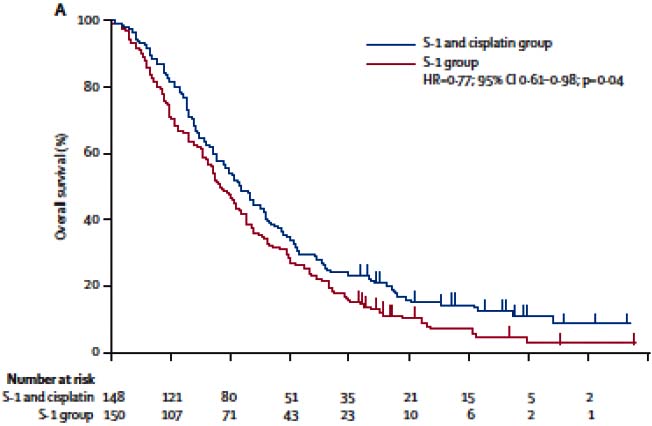
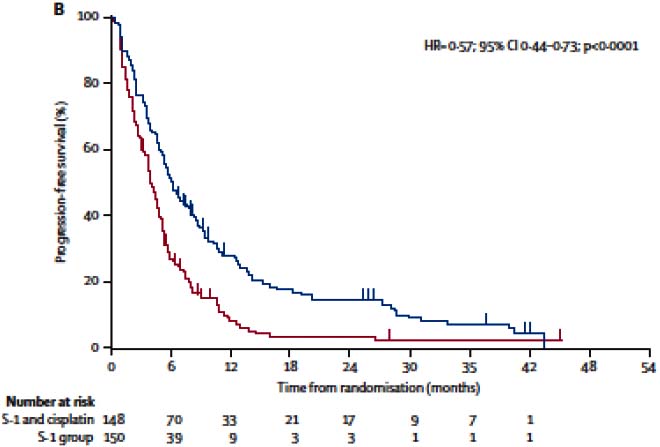
SPIRITS試驗:在一項以305例日本晚期胃癌患者為對象,比較替吉奧膠囊單藥(以下簡稱單藥組,連續28天口服替吉奧膠囊40~60mg/次,每日2次,每6周重複)和替吉奧膠囊聯合順鉑治療(以下簡稱聯合治療組,連續21天口服替吉奧膠囊40~60mg/次,每日2次,第8天給予順鉑60mg/m[sup]2[/sup],每5周重複)的多中心Ⅲ期隨機對照試驗中,主要終點指標為總生存期(OS),次要指標為無進展生存時間(PFS)和腫瘤緩解率。兩組的患者基線特徵是均衡可比。在分析的298例患者中,聯合治療組(148例)和單藥組(150例)中位生存時間分別為13個月和11個月,組間總生存期Hazard比為0.77(95%置信區間0.61-0.98,Log-rank檢驗p=0.04),與單藥組相比,聯合治療可降低死亡風險約23%;兩組中位PFS分別為6個月和4個月,Hazard比為0.57(95%置信區間0.44-0.73,Log-rank檢驗p[0.0001),與對照組相比,本品/順鉑聯合化療可降低復發風險約43%。另外在193例可評價靶病灶病例中,聯合治療組和單藥組的客觀緩解率分別為54%(95%置信區間43-65%)和31%(95%置信區間23-41%;Fisher檢驗,p=0.002)。
SC-101試驗:一項由中國15個研究中心參加的隨機對照多中心臨床研究,230例晚期胃癌患者隨機分為替吉奧單藥組(以下簡稱單藥組,80例,連續28天口服替吉奧膠囊40~60mg/次,每日2次,每6周重複)、替吉奧聯合順鉑組(以下簡稱聯合治療組,76例,連續21天口服替吉奧膠囊40~60mg/次,每日2次,第8天給予順鉑60mg/m[sup]2[/sup],每5周重複)和氟尿嘧啶聯合順鉑組(以下簡稱對照組,74例,氟尿嘧啶600mg/m[sup]2[/sup]/日靜脈輸注,順鉑20mg/m[sup]2[/sup]/日,靜滴30分鐘,第1~5天給藥,每4周重複)。所有患者均需堅持給藥,直至腫瘤進展或無法耐受。其中對照組治療失敗患者可繼續使用替吉奧單藥進行二線治療。主要觀察指標為腫瘤緩解率,次要指標為總生存期(OS)和治療失敗時間(TTF)。三組患者的基線人口特徵均衡可比。獨立療效評價委員會對影像學資料按照RECIST標準進行評價,結果顯示,在224例患者中,聯合治療組(74例)、單藥組(77例)和對照組(73例)腫瘤緩解率分別為37.8%、24.7%和19.2%,聯合治療組顯著優於對照組(CMH檢驗,p=0.021);對照組治療失敗後有41例患者接受了替吉奧單藥二線治療,腫瘤緩解率為14.6%。聯合治療組、單藥組和對照組的中位OS分別為433天、267天、309天(對照組生存期含41例治療失敗後轉至替吉奧單藥二線治療病例),聯合治療組顯著優於對照組(Log-rank檢驗,p=0.038)和單藥組(Log-rank檢驗,p<0.001);中位TTF分別為159天、126天和85天,聯合治療組顯著優於對照組(Log-rank,p<0.001)和單藥組(Log-rank,p=0.008)。
⑵ 單藥治療
總結口服替吉奧膠囊(每日80-150mg,按替加氟計)每日2次的臨床試驗結果,胃癌有效率為46.5%(60/129)。該結果包括在日本進行的以消化道腫瘤為對象的本品單藥化療早Ⅱ期試驗和以胃癌為對象的2項晚Ⅱ期臨床試驗。各試驗詳細情況如下。
早Ⅱ期試驗:以晚期胃癌為對象,連續28天口服替吉奧膠囊50-75mg/次,每日2次,每6周重複,給藥2周期以上。共入選31例,可評價療效病例28例(其中復治患者9例),客觀緩解率為53.6%(15/28、90%置信區間38.4-68.1%)。
晚Ⅱ期臨床試驗(胃癌T試驗):以晚期胃癌患者為對象,連續28天口服替吉奧膠囊40~60mg/次,每日2次,每6周重複。共入選51例,均為可評價療效病例(包括原發病灶評價病例),其中完全緩解1例、部分緩解24例,客觀緩解率49%(25/51、95%置信區間35.9-62.3%)。
晚Ⅱ期臨床試驗(胃癌K試驗):以晚期胃癌患者為對象,連續28天口服替吉奧膠囊40~60mg/次,每日2次,每6周重複。共入選51例,其中可評價療效病例50例(包括原發病灶評價病例),其中部分緩解20例,客觀緩解率40.0%(20/50、95%置信區間30.4-58.9%)。


藥理毒理
藥理作用
替吉奧可抑制裸鼠(大鼠和小鼠)人胃癌、結直腸癌、乳腺癌、肺癌、胰腺癌和腎癌皮下移植的生長,可延長小鼠Lewis肺癌和L5178Y轉移模型生存時間,抑制人胃癌和結直腸癌細胞系同位移植裸鼠模型的腫瘤生長。
替吉奧膠囊由替加氟(FT)、吉美嘧啶(CDHP)和奧替拉西鉀(Oxo)組成。其作用機制為:
口服後FT在體內逐漸轉化成5-氟尿嘧啶(5-FU)。CDHP選擇性可逆抑制存在於肝臟的5-FU分解代謝酶——DPD,從而提高來自FT的5-FU的濃度。伴隨著體內5-FU濃度的升高,腫瘤組織內5-FU磷酸化產物——5-氟核苷酸可維持較高濃度,從而增強抗腫瘤療效。Oxo口服後分布於胃腸道,可選擇性可逆抑制乳清酸磷酸核糖轉移酶,從而選擇性抑制5-FU轉化為5-氟核苷酸,從而在不影響5-FU抗腫瘤活性的同時減輕胃腸道毒副反應。
5-FU的主要作用機理是通過其活性代謝產物FdUMP和dUMP與胸腺嘧啶核苷酸合成酶競爭性結合,同時與還原型葉酸形成三聚體,從而抑制DNA的合成。另外,5-FU轉化為FUTP並整合至RNA分子,從而破壞RNA功能。
毒理研究
長期毒性試驗結果顯示,本品對SD大鼠、Beagle犬連續口服給藥13-52周,主要毒性作用靶器官是骨髓造血幹細胞。
替吉奧可抑制裸鼠(大鼠和小鼠)人胃癌、結直腸癌、乳腺癌、肺癌、胰腺癌和腎癌皮下移植的生長,可延長小鼠Lewis肺癌和L5178Y轉移模型生存時間,抑制人胃癌和結直腸癌細胞系同位移植裸鼠模型的腫瘤生長。
替吉奧膠囊由替加氟(FT)、吉美嘧啶(CDHP)和奧替拉西鉀(Oxo)組成。其作用機制為:
口服後FT在體內逐漸轉化成5-氟尿嘧啶(5-FU)。CDHP選擇性可逆抑制存在於肝臟的5-FU分解代謝酶——DPD,從而提高來自FT的5-FU的濃度。伴隨著體內5-FU濃度的升高,腫瘤組織內5-FU磷酸化產物——5-氟核苷酸可維持較高濃度,從而增強抗腫瘤療效。Oxo口服後分布於胃腸道,可選擇性可逆抑制乳清酸磷酸核糖轉移酶,從而選擇性抑制5-FU轉化為5-氟核苷酸,從而在不影響5-FU抗腫瘤活性的同時減輕胃腸道毒副反應。
5-FU的主要作用機理是通過其活性代謝產物FdUMP和dUMP與胸腺嘧啶核苷酸合成酶競爭性結合,同時與還原型葉酸形成三聚體,從而抑制DNA的合成。另外,5-FU轉化為FUTP並整合至RNA分子,從而破壞RNA功能。
毒理研究
長期毒性試驗結果顯示,本品對SD大鼠、Beagle犬連續口服給藥13-52周,主要毒性作用靶器官是骨髓造血幹細胞。
藥代動力學
1. 藥代動力學
⑴ 12例腫瘤患者餐後單次口服替吉奧膠囊32-40mg/m[sup]2[/sup]後的藥代動力學參數如下表所示。服藥72小時內有52.8%的吉美嘧啶(CDHP)、7.8%的替加氟(FT)、2.2%的奧替拉西鉀(Oxo)、11.4%的代謝物氰尿酸(CA)和7.4%的氟尿嘧啶(5-FU)從尿中排泄。
替吉奧膠囊25-200mg/人口服給藥後可見FT、CDHP、Oxo和5-FU的AUC和Cmax呈劑量依賴性增加。替吉奧膠囊32-40mg/m[sup]2[/sup]、每日2次、連續給藥28天,給藥第1、7、14和28天檢測血藥濃度,發現其迅速達到穩態水平。即使在連續給藥結束後,內源性尿嘧啶仍迅速降低,提示CDHP的DPD抑制作用具有可逆性,未見任何增強作用。
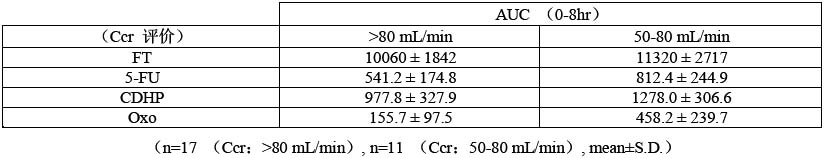
⑵ 在臨床藥理學、胰腺癌、膽管癌試驗中,詳細檢測了患者藥代動力學指標,根據其血清肌酐值、性別、年齡和體重,利用Cockcroft-Gault公式計算其肌酐清除率(Ccr估算值),據此將其分為腎功能正常組和腎功能輕度異常組,其AUC計算結果如下。
2. 蛋白結合率
FT、CDHP、Oxo和5-FU的人血清蛋白結合率分別為49-56%、32-33%、7-10%和17-20%(體外實驗)。
3. 代謝酶
研究發現人肝臟微粒體內的細胞色素P450同功酶中,主要參與FT轉化為5-FU者為CYP2A6(體外實驗)。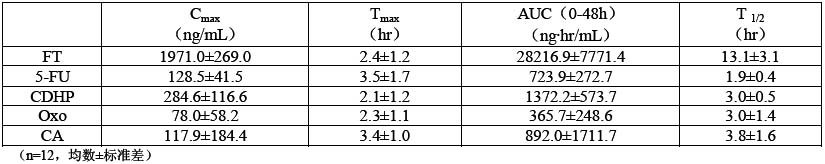
⑴ 12例腫瘤患者餐後單次口服替吉奧膠囊32-40mg/m[sup]2[/sup]後的藥代動力學參數如下表所示。服藥72小時內有52.8%的吉美嘧啶(CDHP)、7.8%的替加氟(FT)、2.2%的奧替拉西鉀(Oxo)、11.4%的代謝物氰尿酸(CA)和7.4%的氟尿嘧啶(5-FU)從尿中排泄。
替吉奧膠囊25-200mg/人口服給藥後可見FT、CDHP、Oxo和5-FU的AUC和Cmax呈劑量依賴性增加。替吉奧膠囊32-40mg/m[sup]2[/sup]、每日2次、連續給藥28天,給藥第1、7、14和28天檢測血藥濃度,發現其迅速達到穩態水平。即使在連續給藥結束後,內源性尿嘧啶仍迅速降低,提示CDHP的DPD抑制作用具有可逆性,未見任何增強作用。
⑵ 在臨床藥理學、胰腺癌、膽管癌試驗中,詳細檢測了患者藥代動力學指標,根據其血清肌酐值、性別、年齡和體重,利用Cockcroft-Gault公式計算其肌酐清除率(Ccr估算值),據此將其分為腎功能正常組和腎功能輕度異常組,其AUC計算結果如下。
2. 蛋白結合率
FT、CDHP、Oxo和5-FU的人血清蛋白結合率分別為49-56%、32-33%、7-10%和17-20%(體外實驗)。
3. 代謝酶
研究發現人肝臟微粒體內的細胞色素P450同功酶中,主要參與FT轉化為5-FU者為CYP2A6(體外實驗)。


貯藏
室溫,密封保存。
包裝
鋁塑泡罩包裝。
20mg規格:140粒/盒(14粒×10板);56粒/盒(14粒×4板)28粒/盒(14粒×2板)
25mg規格:140粒/盒(14粒×10板);56粒/盒(14粒×4板)28粒/盒(14粒×2板)
20mg規格:140粒/盒(14粒×10板);56粒/盒(14粒×4板)28粒/盒(14粒×2板)
25mg規格:140粒/盒(14粒×10板);56粒/盒(14粒×4板)28粒/盒(14粒×2板)
有效期
36個月
執行標準
進口藥品註冊標準:JX20040255
生產企業
大鵬藥品工業株式會社德島工廠
委託企業
大鵬藥品工業株式會社
核准日期
2009年01月09日
修訂日期
2010年10月13日
