平衡近似又稱平衡假設。化學動力學中,處理含有連續和對峙反應等複雜反應的一種近似方法。
基本介紹
- 中文名:平衡近似
- 又稱:平衡假設
- 化學動力:處理有連續和對峙反應等複雜反應
- 說明:一種對不穩定中間產物的化學反應
定義
說明
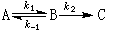 ①
①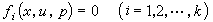 ②
②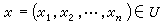 ③
③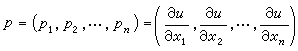 ④
④平衡近似又稱平衡假設。化學動力學中,處理含有連續和對峙反應等複雜反應的一種近似方法。
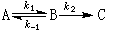 ①
①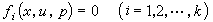 ②
②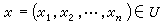 ③
③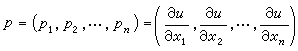 ④
④平衡近似又稱平衡假設。化學動力學中,處理含有連續和對峙反應等複雜反應的一種近似方法。...
在一個含有對峙反應的連續反應中,如果在對峙反應後存在速控步驟,則總反應速率及表觀速率常數僅取決於速控步及它以前的平衡過程,與速控步以後的各快反應無關。...
平衡法則也稱平衡規律,是《一般平衡論》(汪葉斌著)提出的一個重概念。一般平衡論的六個平衡法則是“天道自衡”的具體表達,包括:⑴平衡循環(平衡→不平衡→新平衡...
平衡態(equilibrium state)是指在沒有外界影響條件下熱力學系統 的各部分巨觀性質在長時間裡不發生變化的狀態。這裡所說的沒有外界影響,是指系統與外界沒有相互...
維恩近似(Wien Approximation、Wien distribution law或also sometimes called Wien's law)(或稱為維恩逼近、維也納逼近、維恩定律或維恩輻射定律),是物理學用來描述...
平衡理論這個理論認為人們用一種平衡的方式自發地組織他們的好惡。當兩個人互相喜歡對方而且發現他們在很多方面具有相似性時,這就表現為平衡( balance),而且平衡是...
《一般平衡論》(汪葉斌 著)是一門研究一般系統平衡規律的理論,也是一個自成體系的平衡哲學。《一般平衡論》的基本框架由其核心思想“天道自衡”,包括物質觀、時空...
玻恩–奧本海默近似(Born-Oppenheimer approximation,簡稱BO近似,又稱絕熱近似)是一種普遍使用的解包含電子與原子核的體系的量子力學方程的近似方法。...
平衡分布是指熱力學系統達到平衡後,組成系統的N個粒子在粒子許可能級上的分布。...... 套用Stirling近似公式,並考慮 ,上式演化為若選定m從 變至 ,則在此間隔範圍...
在力學系統里,平衡是指慣性參照系內,物體受到幾個力的作用,仍保持靜止狀態,或勻速直線運動狀態,或繞軸勻速轉動的狀態,叫做物體處於平衡狀態,簡稱物體的“平衡”。...
平衡態熱力學方法又稱經典熱力學方法。是從能量觀點出發,研究巨觀平衡系統的性質,並建立平衡的一般規律的方法。它研究平衡系統的有序穩定結構,以及從一個平衡狀態...
平衡吸附(uilihrium adsorption)操作方法。當被處理的溶液通過吸附劑填充的固定床時,溶液中的濟質迅速i旬吸附劑顆粒表面擴散移動}}i其吸附速度和解吸速度相等時...
近似穩態,是一種對不穩定中間產物的化學反應動力學近似處理的方法。適用於有活潑中間物的連續反應。...
在一定的溫度下,電子從低能量的量子態躍遷到高能量的量子狀態及電子從高能量的量子態躍遷到低能量的量子態這兩個相反過程之間建立起動態平衡,稱為熱平衡狀態。...
平衡二叉樹(Self-balancing binary search tree)又被稱為AVL樹(有別於AVL算法),且具有以下性質:它是一 棵空樹或它的左右兩個子樹的高度差的絕對值不超過1,...
分配平衡規律指在恆溫恆壓條件下,溶質在互不相溶的兩相中達到分配平衡。如果其在兩相中的相對分子質量相等,則其在兩相中的平衡濃度之比為常數,即A=c2/c1為常數...
迴轉平衡分為動平衡和靜平衡,由於迴轉件的結構形狀不對稱、製造安裝不準確或材質不均勻等原因,在轉動時產生的離心力和離心力偶矩不平衡,致使迴轉件內部產生附加應力...
熱化學平衡是化學平衡的一種類型。指受溫度高低的影響會使平衡移動的一種可逆反應。...
“哈迪-溫伯格定律”是指在理想狀態下,各等位基因的頻率和等位基因的基因型頻率在遺傳中是穩定不變的,即保持著基因平衡。該定律運用在生物學、生態學、遺傳學。...
