分配平衡規律指在恆溫恆壓條件下,溶質在互不相溶的兩相中達到分配平衡。如果其在兩相中的相對分子質量相等,則其在兩相中的平衡濃度之比為常數,即A=c2/c1為常數,A稱為分配常數。
基本介紹
- 中文名:分配平衡
- 外文名:Distribution of balance
- 釋義:在互不相溶的兩相中達到分配平衡
- 描述:分配係數和分配比
簡介
分配係數
 計算公式
計算公式
分配比
 計算公式
計算公式
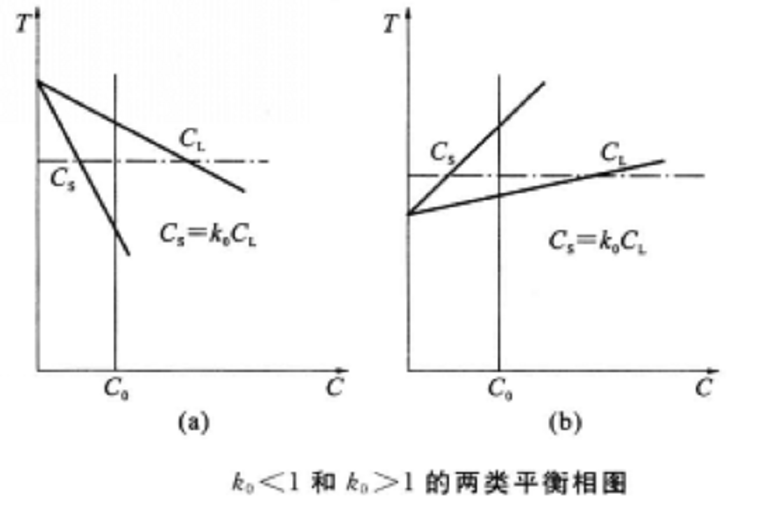
分配平衡規律指在恆溫恆壓條件下,溶質在互不相溶的兩相中達到分配平衡。如果其在兩相中的相對分子質量相等,則其在兩相中的平衡濃度之比為常數,即A=c2/c1為常數,A稱為分配常數。
 計算公式
計算公式
 計算公式
計算公式
分配平衡規律指在恆溫恆壓條件下,溶質在互不相溶的兩相中達到分配平衡。如果其在兩相中的相對分子質量相等,則其在兩相中的平衡濃度之比為常數,即A=c2/c1為常數...
平衡分配模型是指採用Wardrop平衡原理實現交通分配的數學模型。交通分配模型近十餘年來在非平衡分配模型基礎上發展起來的一個重要分支。常分為固定需求分配法、彈性...
平衡分配係數是指在固液兩相體系達平衡狀態時,溶質在兩相中的濃度的比值。分配係數反映了溶質在兩相中的遷移能力及分離效能,是描述物質在兩相中行為的重要物理化學...
組合平衡分配法是“平衡分配模型”的一種方法。將交通量分配與出行分布或方式劃分同步進行的一種平衡分配模型。簡化了交通量的預測過程,但引人了分配與分布或與方式...
分配平衡常數partition equil}i}tium con,tant;parritiun。。- elficiFnt;'Vernsr partition tonxtant指同一分子在兩相間的 Vernst分配平衡常數,符號以n表不。...
分配定律是描述溶質在兩個互不相溶的液體中的分配的定律。分配定律在地球化學上的套用已十分廣泛,並且取得了可喜的成果,隨著我國地球化學和化探工作的進一步發展,...
分配係數,是指在一定溫度下,達到分配平衡時某一物質在兩種互不相溶的溶劑中的活度(常近似為濃度)之比。為一常數。分配係數可用於表示該物質對兩種溶劑的親和性...
1952年著名學者Wardrop提出了交通網路平衡定義的第一原理和第二原理,奠定了交通流分配的基礎。...
分配比是指在溶劑萃取過程中,當萃取體系達到平衡後,被萃物在有機相的總濃度和在水相的總濃度之比。...
能斯特分配定律是指在一定的溫度和壓力條件下,元素在共存相間的分配達到平衡時,其活度比是一常數。...
國際收支經常帳戶差額與資本帳戶差額不能相抵時使借貸雙方總計得以達到平衡的項目。 國際收支平衡表的借貸總計應當相等。國際收支經常帳戶的借方差額與資本帳戶的貸方...
平衡分析(Balance Analysis),平衡分析是分析事物之間相互關係的一種方法。它分析事物之間發展是否平衡,揭示出事物間出現的不平衡狀態、性質和原因,指引人們去研究積極...
某一種物質在兩種(有機溶劑、水)互不混溶的溶劑中有不同的溶解度。在一定溫度和一定pH條件下,在有機溶劑和水溶液中溶解度的比值為一常數,該常數稱分配係數。...
某物質在兩種互不混溶的液體體系中達到平衡時,在這兩相中溶解的量有一定分配的現象。分配作用遵循分配定律,即達平衡後,某物質在這兩互不混溶液相中濃度的比為...
分配決策對於國有獨資企業來說,主要涉及到如何處理好國家、集體和個人的關係問題;對於公司制企業來說,主要涉及諸如股東分紅占總盈利的比例、股息在一定時期內的穩定...
供求平衡是指消除供求之間的不適應、不平衡現象,使供應與需求相互適應,相對一致,消除供求差異,實現供求均衡。...
用地平衡是指確定各類用地的合宜面積分配與比例關係,編制用地平衡表,從而得出以人為單位的用地面積數,以此分析和比較。...
平衡投資策略是指旨在平衡風險及回報的投資組合分配及管理方法。投資策略是指對投資資產根據不同需求和風險承受能力進行的安排、配製。包括選擇股票、債券、商品期貨及...
資源平衡簡稱“平衡”。亦稱“有限資料進度計畫"。當資源成為制約項目進度計畫的因素時,所採用的分析方法。將資源有效分配到項目活動中,其目的是減少資源過度分配,...
均衡,漢語辭彙。拼音:jūn héng指平衡。如:均衡發展。... 均衡:指布局上的等量不等形的平衡。 有兩種平衡形式...有變化就沒有美感,所以構圖最忌諱的就是平均分配...
