簡介
根據L.C.鮑林的價鍵理論,具有八面體結構並有4個未成對電子的、順磁性的【CoF】,或有5個未成對電子的、順磁性的【Fe(HO)】,其配位成鍵雜化軌道為4s4p4d,所用d 軌道與s和p軌道是屬於同一主能級的。這類具有spd形式的配合物(見配位化合物), 因為使用了外層的d軌道,所以叫做外軌配合物。兩種配合物的雜化成鍵軌道分別如圖所示。對於具有八面體結構且所有電子都是成對的、抗磁性的【Co(NH)】, 或具有1個未成對電子的、 順磁性的【Fe(CN)】,其成鍵雜化軌道為3d4s4p,使用了比s和p軌道低一級主能級層中的d軌道。這類具有(-1)dsp型式的配合物,由於使用了內層的d軌道,所以叫做內軌配合物。
在四配位體系中,具有四面體結構且有兩個未成對電子的順磁性的【NiCl】,其成鍵雜化軌道為4s4p,屬外軌配合物。而所有電子都成對的、抗磁性的【Ni(CN)】,其成鍵雜化軌道為3d4s4p,是平面正方形結構,屬內軌配合物。
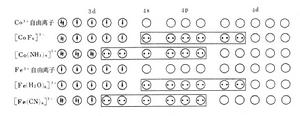 外軌配合物和內軌配合物
外軌配合物和內軌配合物定義
根據中心原子雜化時所提供的空軌道所屬電子層的不同,配合物可分為兩種類型,即外軌配合物和內軌配合物。
若中心原子全部用最外層價電子的空軌道(ns、np、nd) 雜化成鍵,所形成的配鍵稱外軌配鍵,對應的配合物稱外軌配合物;另一種是中心原子用了次外層d 軌道,即(n - 1)d和最外層的ns,np 軌道進行雜化成鍵,所形成的配鍵稱內軌配鍵,對應的配合物稱為內軌配合物。如中心原子採取sp、sp3、sp3d2雜化軌道成鍵,形成配位數為2、4、6的配合物都是外軌配合物,中心原子採取dsp2或 d2sp3雜化軌道成鍵形成配位數為4 或 6 的配合物都是內軌配合物。
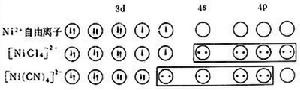 外軌配合物和內軌配合物
外軌配合物和內軌配合物影響因素
配合物是內軌型還是外軌型,主要取決於中心離子的電子構型、離子所帶的電荷和配位原子的電負性大小。
具有(n - 1)d10構型的離子,只能用外層軌道形成外軌型配合物;具有(n - 1)d8構型的離子如在大多數情況下形成內軌塑配合物;具有(n-1 )d4-d7構型的離子,既可形成內軌型,也可形成外軌型配合物;具有(n - 1) d1-3構型的離子,一般形成內軌配合物。這類配合物往往含有空的(n - 1)d軌道,而含有空(n - 1)d軌道的內軌配合物大多不穩定。
中心離子的電荷增多有利於形成內軌型配合物。因為中心離子的電荷較多時,它對配位原子的孤電子對引力增強,利 於以其層 d 軌道參與成鍵。電負性大的原子如F、O等 ,與電負性較小的C 原子比較,通常不易提供孤電子對,它們作為配位原子時,中心離子以外層軌道與之成鍵,因而形成外軌型配合物。C原子作為配位原子時 則常形成內軌型配合物 。
內軌型配合物和外軌型配合物,其穩定性是不同的,一般內軌型配合物比外軌型配合物穩定。
配合物簡介
為一類具有特徵
化學結構的化合物,由
中心原子(或離子,統稱中心原子)和圍繞它的分子或離子(稱為
配位體/配體)完全或部分通過配位鍵結合而形成。
包含由中心
原子或離子與幾個
配體分子或離子以
配位鍵相結合而形成的複雜分子或離子,通常稱為配位單元。凡是含有配位單元的化合物都稱作配位化合物。研究配合物的化學分支稱為
配位化學。
配合物是化合物中較大的一個子類別,廣泛套用於日常生活、工業生產及生命科學中,近些年來的發展尤其迅速。它不僅與
無機化合物、
有機金屬化合物相關連,並且與現今化學前沿的
原子簇化學、配位催化及分子生物學都有很大的重疊。
顯然含有配位鍵的化合物就不一定是配位化合物,如硫酸及銨鹽等化合物中儘管有配位鍵,但由於沒有過渡金屬的原子或離子,故它們也就不是配位化合物。當然含有過渡金屬離子的化合物也不一定是配位化合物,如氯化鐵、硫酸鋅等化合物就不是配位化合物。
 外軌配合物和內軌配合物
外軌配合物和內軌配合物 外軌配合物和內軌配合物
外軌配合物和內軌配合物