基本介紹
- 中文名:配合物價鍵理論
- 屬性:理論
- 學科:化學
基本要點
外軌配合物和內軌配合物
定義
影響因素
配合物的磁性與鍵型的關係
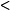
1927年W.H.海特勒和F.W.倫敦首次完成了氫分子中電子對鍵的量子力學近似處理,這是近代價鍵理論的基礎。L.C.鮑林等加以發展,引入雜化軌道概念,綜合成價鍵理論 ...
《配合物及其套用》講述了配位化學簡史和基本概念,配合物的結構和異構現象,配合物的化學鍵理論,配合物在溶液中的穩定性,配合物的反應動力學等內容。[1] ...
1893年,瑞士化學家維爾納總結了前人的理論,首次提出了現代的配位鍵、配位數和配位化合物結構等一系列基本概念,成功解釋了很多配合物的電導性質、異構現象及磁性。...
配位場理論是說明和解釋配位化合物的結構和性能的理論。在有些配合物中,中心離子(通常也稱中心原子)周圍被按照一定對稱性分布的配位體所包圍而形成一個結構單元。...
殼層離子(或分子),如過渡金屬配合物Mn+(X-)m,它們之間形成配位鍵(屬共價鍵...價鍵理論是20世紀30年代由海特勒倫敦( Heitler London)創立、Pauling .Slater等...
價層電子對互斥理論(英文:Valence Shell Electron Pair Repulsion,簡稱為VSEPR),...和烷基配合物(例如六甲基鎢),這個理論的基礎是sd雜化軌道和三中心四電子鍵模型...
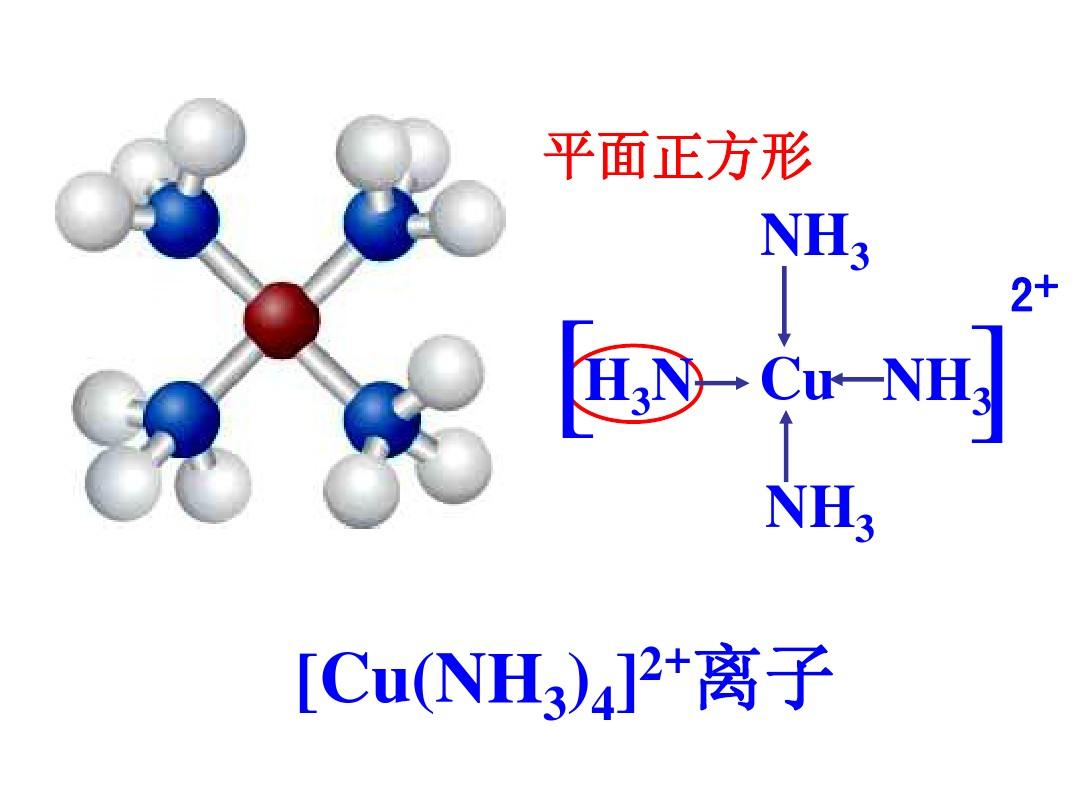
①價鍵理論。認為配體上的電子進入中心原子的雜化軌道。例如鈷(Ⅲ)的配合物。〔CoF6〕3-中F-的孤對電子進入Co3+的sp3d2雜化軌道,這種配合物稱為外軌配合物或...
1948年,鮑林提出電中性原理,進一步完善了價鍵理論。該原理指出,在形成一個穩定的分子或配離子時,其電子結構是竭力設法使每個原子的淨電荷基本上等於零(即在-1到...
12.1配合物的空間構型和異構現象17412.1.1配合物的空間構型17412.1.2配合物的異構現象17412.2配合物的價鍵理論17612.2.1價鍵理論的要點176...
一、配合物的組成二、配合物的命名三、配合物的異構現象四、配合物的價鍵理論五、晶體場理論六、配位平衡常數七、影響配合物穩定性的因素八、配位平衡的移動...
4 2配合物結構的價鍵理論87 4 2 1雜化軌道和空間構型87 4 2 2外軌型配合物和內軌型配合物90 4 3配合物結構的晶體場理論91 4 3 1晶體場理論的基本要點...
14.4配合物的價鍵理論14.5晶體場理論14.6配位平衡及其平衡常數14.7配位平衡的移動14.8配位化合物的套用第15章元素化學15.1s區元素...
配位化學價鍵理論 主要是由L.C.鮑林發展起來的。該理論認為配合物是在路易斯鹼(配體)和路易斯酸(金屬或金屬離子)之間反應生成(見酸鹼理論),在配體和金屬之間有...
第9章配合物9.1配合物的基本概念9.2配合物的類型9.3配合物的價鍵理論9.4配合物的性質9.5配位平衡及配合物的穩定性9.6配合物的套用本章小結...
①價鍵理論。認為配體上的電子進入中心原子的雜化軌道。例如鈷(Ⅲ)的配合物。〔CoF6〕3-中F的孤對電子進入Co3+的sp3d2雜化軌道,這種配合物稱為外軌配合物或...
8.2 配合物的結構8.2.1 配合物的空間構型和磁性8.2.2 配合物的價鍵理論8.2.3 配合物的晶體場理論8.3 配合物的穩定性與配位平衡...
10.2配合物的化學鍵理論 10.2.1配合物的價鍵理論 10.2.2配合物的晶體場理論 10.3配位平衡 10.3.1配離子的穩定常數 10.3.2配位平衡的移動 10.4螯合物...
第一節 配位化合物的基本概念一、配合物及其組成二、配合物的化學式及命名三、配合物的類型第二節 配合物的價鍵理論一、價鍵理論的基本要點...
以介紹化學基本知識基礎理論為主線,結合實際套用,按化學學科的科學性和系統性編撰...10.2配合物的化學鍵理論10.2.1價鍵理論10.2.2晶體場理論簡介...
4.1.2 配合物的定義、組成與命名 4.2 價鍵理論 4.2.1 價鍵理論的要點 4.2.2 中心離子的雜化軌道 4.2.3 價鍵理論的套用 4.3 晶體場理論 4.3.1 晶...
簡明介紹了結構化學的相關理論知識,具體內容包括量子力學基礎,原子的結構與性質,分子的對稱性,分子軌道理論,價鍵理論,配合物的化學鍵理論,分子的物理性質及次級鍵,...
10.1配合物的基本特徵 10.1.1配合物及其命名 10.1.2配合物的異構現象 10.2配合物的化學鍵理論 10.2.1價鍵理論 10.2.2晶體場理論簡介 *10.3非經典配合...
《高等配位化學》一書共10章,介紹了配合物的功能套用性、配合物製備以及功能配合物的套用領域;《高等配位化學》對配合物的理論研究、實驗研究、配合物的基礎性...
第12章 配位化合物12.1 配位化合物的基本概念、命名和結構 12.2 配合物的價鍵理論12.3 晶體場理論 12.4 配合物的穩定性 12.5 配位平衡...
