簡介
均相催化是近年來發展的一種新的
催化反應,與多相催化相比,具有反應活性大、條件溫和、選擇性較好、催化劑不易中毒等優點。在用於氫化時,不會導致烯鍵發生異構化和氫解反應,並可用於不對稱氫化還原。
均相催化劑主要是過渡族金屬銠、釕和銥的三苯膦絡合物,如氯化三苯膦絡銠(Ph3P)3—RhCl,
氯氫三苯膦絡釕(Ph3P)3RuClH,氫化三苯膦絡銥(Ph3P)3lrH等。氯化三苯膦絡銠可用氯化銠同過量的三苯膦在醇中回流製得。
 反應方程式
反應方程式反應機理
由於催化劑氣化三苯膦絡銠(102)的中心原子銠,能以其d軌道與氫、溶劑、烯鍵等形成配位絡合物而起了催化作用。在反應時,首先在溶劑(S)中離解生成二(三苯膦)氯銠和溶劑分子(S(的絡合物(103),然後與氫分子生成二氫絡合物(104)。同時氫進行了在還原時,反應物分子置換了(104)中的
溶劑分子,生成中間絡合物(105),(103)再繼續參加順式加成。最後解離為還原產物和溶劑化的二(三苯膦)氯銠即(103),(103)再繼續參加反應。
 反應機理
反應機理均相催化氫化過程用下圖說明:
 均相催化氫化過程示意圖
均相催化氫化過程示意圖套用範圍
選擇性還原
一些在多相氫化中易於還原的基團如硝基、氰基、偶氮基等在均相氫化中不發生反應,因而在多功能基分子的還原中,可選擇性地保留以上基團。例如,ω一硝基苯乙烯,在均相氫化中可保留硝基而還原得到ω一硝基苯乙烷。
 反應方程式
反應方程式由於均相催化劑含有立體位阻很大的三苯膦結構,多取代烯鍵衍生物的立體位阻較大,不易與之形成絡合物,故均相催化可選擇性的還原單取代烯(端基烯鍵),而保留分子中的多取代烯鍵。如蕪荽醇(106)可氫化為二氫芫荽醇(107)而保留了三取代烯鍵。
 反應方程式
反應方程式不發生氫解反應
在多相氫化反應中,若反應物分子中含有易氫解的基團,氫化後往往伴隨氫解的
副反應,而使產物的收率及質量下降。均相氫化則能避免氫解反應,從而增加了反應的選擇性。例如,肉桂酸苄酯(108) 可還原為苯丙酸苄酯(109),烯丙基硫酚(110)可還原為丙基硫酚(111),而不導致苄基和烯丙基的氫解。
 反應方程式
反應方程式不對稱氫化
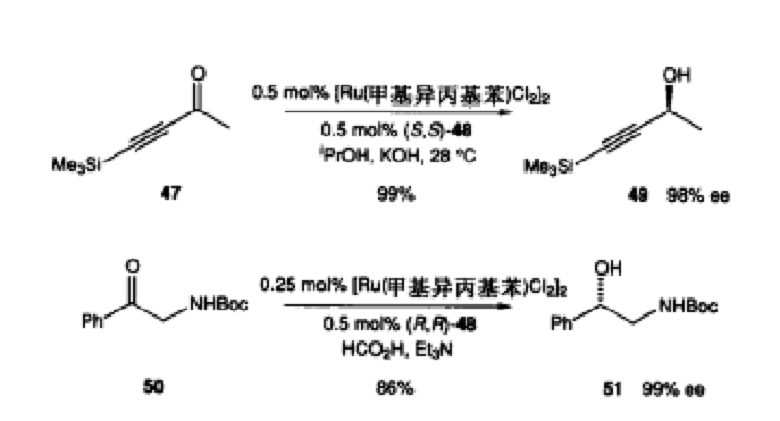
將均相催化劑氯化三苯膦絡銠中的一個苯基換成手征性配基,如化合物(112),則成為可溶性的手征性催化劑,可用以進行不對稱氫化。所得產物的光學純度較好。如下圖所示:
 反應方程式
反應方程式 反應方程式
反應方程式 反應機理
反應機理 均相催化氫化過程示意圖
均相催化氫化過程示意圖 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式