基本介紹
- 中文名:噴泉實驗
- 產生機理:克拉伯龍方程
- 實驗關鍵:燒瓶不能漏氣等
- 發生實例:極易溶於水的氣體和其他等
現象描述
產生機理
實驗關鍵
發生實例
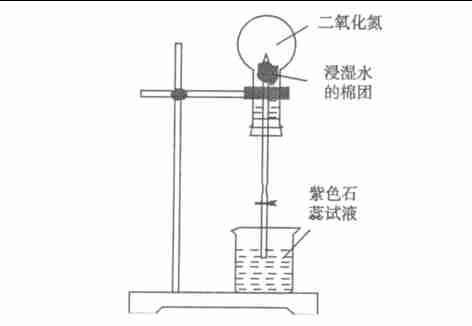 圖2
圖2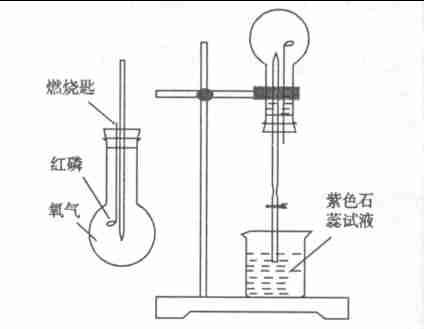 圖3
圖3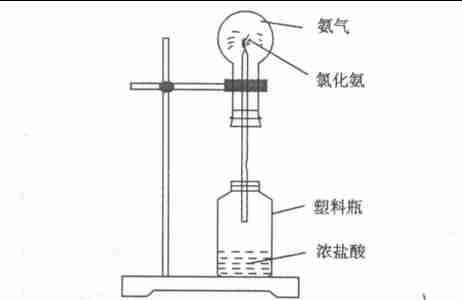 圖4
圖4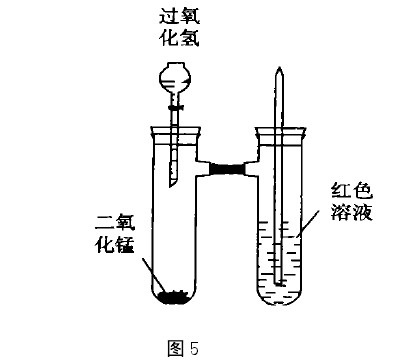
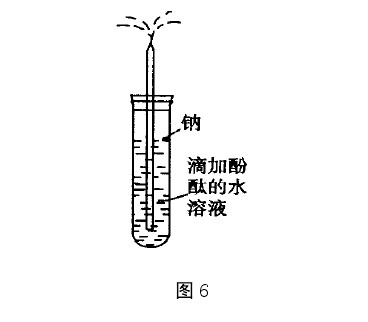
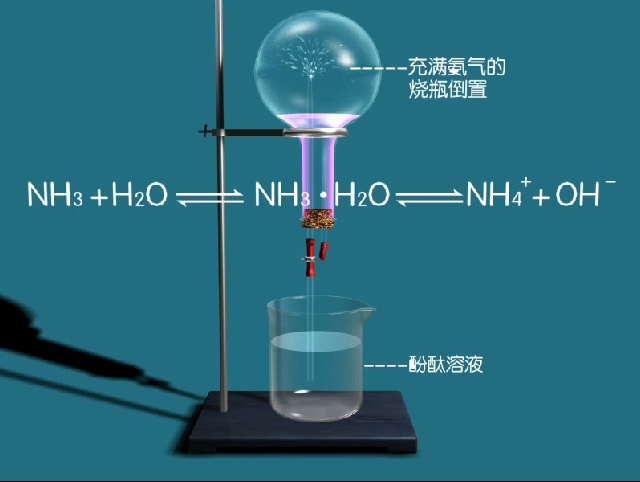
 圖2
圖2 圖3
圖3 圖4
圖4

噴泉實驗是中學化學教學中的一個演示實驗,高一化學教材在講到氨的性質時,安排了噴泉實驗。由於噴泉實驗的趣味性強,直觀效果好,如今已超越教材中安排的噴泉實驗的範圍...
氨氣噴泉實驗,是一種常見的中學化學演示實驗,被用於演示氨氣的性質。...... 氨氣噴泉實驗,是一種常見的中學化學演示實驗,被用於演示氨氣的性質。目錄 1 基本內容 2...
可樂噴泉是指可樂因為氣壓從瓶口噴涌而出所形成的噴泉。可樂噴泉是利用可口可樂和曼妥思薄荷糖在一起所發生的物理反應來完成的。薄荷糖里數以千計的小坑是形成...
“套管實驗”是將一隻較小的玻璃儀器裝入另一玻璃儀器中,經組裝來完成原來需要兩套或多套普通玻璃儀器進行的實驗。因其具有許多優點,近年來被廣泛開發,並套用於...
《瘋狂科學實驗體驗書》內容簡介:從飄飛的衛生紙到垃圾桶煙圈,從汽水噴泉到尖叫的氣球,最炫酷的科學體驗,激發創造力與智慧。做個二氧化碳三明治﹑肥皂蛋奶酥﹑釘子當...
實驗室樣品是用於實驗室實驗時的材料,量比較少,存放於規定容器和條件下,在取用和存放上有著嚴格的管理制度。...
《中學物理實驗改進設計與規範操作實用全書(下卷)》是一本於1999年7月中國對外翻譯出版公司出版的圖書。...
《高中化學實驗圖解》是2010年1月由廣西師範大學出版社出版的圖書,作者是凌育南。本書主要以圖片的形式,分步詳細介紹了高中化學實驗的步驟和技巧。...
2.泡沫滅火器反應原理實驗的改進 3.自製漏斗 4.別樣的噴泉實驗 (三)硬紙板的再利用研究 (四)氣球的利用研究 1.用作集氣裝置 2.用作吸收尾氣裝置 ...
劉立新主編的《中學化學實驗教學研究》分為理論和實驗兩個部分。《中學化學實驗教學研究》的理論部分著重提高化學教育專業師範生對中學化學實驗的功能、改革趨勢、教育...
《中學化學實驗研究》以基礎化學教育改革要求為指導,以培養高素質未來化學教師為目的,以《化學課程標準》為準繩,內容以實驗研究為主,包括手持技術實驗研究、改進型...
《中學化學實驗實用手冊》是2006年陝西師範大學出版社出版的圖書,作者是劉勝強。本書是作者在長期的化學實驗教學中,從實驗目的、原理、步驟、成敗關鍵、注意事項、...
內容簡介本教材是山東省高等學校化學實驗新體系立體化系列教材的第一部,是根據當代化學學科發展的實際,為適應化學及相關專業大學一年級學生而編寫的實驗教材。它將...
《新課標高中化學實驗手冊》是2010年湖南師範大學出版社出版的圖書 。本書主要介紹了每一個實驗的操作、原理、現象、結論、注意事項等內容。...
1985年 《噴泉實驗》 目錄 1 個人簡介 2 所獲榮譽 3 工作經歷 4 發表論文 陳輝祖個人簡介 編輯 陳輝祖老師是江蘇省南通第一中學化學教師。參加工作42年,忠...
焰色反應 噴泉實驗 乙醇與重鉻酸鉀的反應 鐵鹽和亞鐵鹽 氨氣的製取一 苯酚與氫氧化鈉的反應 蔗糖碳化現象 氨氣的製取二 甲烷的結構 氯離子的檢驗 氨氣的製取...
周林,男,博士,副研究員。主要研製了原子重力儀,絕對重力測量解析度達到10^-9g;實現了十二米原子噴泉實驗系統;進行了基於冷原子干涉儀的等效原理檢驗實驗,測量精度...
氨的噴泉實驗將250ml的燒瓶里充滿氨氣,倒置於酚酞溶液水槽中,會看到紅色噴泉現象。氨主要用途 編輯 氨的主要用途是氮肥、製冷劑、化工原料。...
實驗室里就是利用此反應來製取氨,同時也利用這個性質來檢驗銨離子的存在。氨氣噴泉實驗 在常溫,常壓下,一體積的水中能溶解700體積的氨。...
