技術介紹,基本原理,操作過程,動物免疫,細胞融合,細胞篩選,克隆化,凍存與復甦,鑑定單抗特性,特點,類型,鼠源性抗體,人鼠嵌合抗體,人源化抗體,小分子抗體,人源性抗體,臨床套用,疾病診斷,疾病治療,食品衛生,
技術介紹
單克隆抗體技術(monoclonal antibody technique) 1975年英國科學家Milstein和Kohler所發明,並獲得1984年
諾貝爾醫學獎。 1984 德國人G. J. F.Kohler、阿根廷人C. Milstein[3]和
丹麥科學家N. K. Jerne由於發展了
單克隆抗體技術,完善了極微量蛋白質的檢測技術而分享了諾貝爾生理醫學獎。 其原理是: B淋巴細胞能夠產生抗體, 但在體外不能進行無限分裂; 而瘤細胞雖然可以在體外進行無限傳代, 但不能產生抗體。將這兩種細胞融合後得到的
雜交瘤細胞具有兩種親本細胞的特性。
免疫反應是人類對疾病具有抵抗力的重要因素。當動物體受抗原刺激後可產生抗體。抗體的特異性取決於抗原分子的決定簇,各種抗原分子具有很多抗原決定
簇,因此,免疫動物所產生的抗體實為多種抗體的混合物。用這種傳統方法製備抗體效率低、產量有限,且動物抗體注入人體可產生嚴重的過敏反應。此外,要把這些不同的抗體分開也極困難。近年,
單克隆抗體技術的出現,是免疫學領域的重大突破。
 單克隆抗體技術
單克隆抗體技術 基本原理
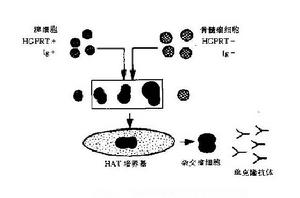
哺乳類細胞DNA合成可分為兩條途徑,①從頭(de novo)合成途徑,利用磷酸核糖焦磷酸和尿嘧啶,可被氨基蝶呤(A)阻斷;②補救(salvag-e)合成途徑,在次黃嘌呤磷酸核糖轉化酶( HGPRT)存在下利用次黃嘌呤(H)和胸腺嘧啶(T)。
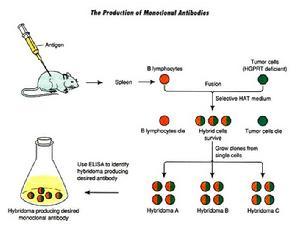
單克隆抗體技術的流程為:脾細胞和骨髓瘤細胞在聚乙二醇(PEG)作用下發生細胞融合;加人HAT選擇培養基(含H、A和T)後,未融合的骨髓瘤細胞因其從頭合成途徑被氨基蝶呤阻斷,而又缺乏HGPRT不能利用補救途徑合成DNA,從而死亡;未融合的脾細胞難以在體外培養而死亡;融合細胞因從脾細胞獲得HGPRT,故可在HAT選擇培養基中存活和增殖。
操作過程
動物免疫
(1) 抗原製備。製備單克隆抗體的免疫抗原,從純度上說雖不要求很高,但高純度的抗原使得到所需單抗的機會增加,同時可以減輕篩選的工作量。因此,免疫抗原是越純越好,應 根據所研究的抗原和實驗室的條件來決定。一般來說,抗原的來源有限,或性質不穩定,提純時易變性,或其免疫原性很強,或所需單抗是用於抗原不同組分的純化 或分析等,免疫用的抗原只需初步提純甚至不提純,但抗原中混雜物很多,特別是如果這些混雜物的免疫原性較強時,則必須對抗原進行純化。檢測用抗原可以是與 免疫抗原純度相同,也可是不同的純度,這主要決定於所用篩檢方法的種類及其特異性和敏感性。
(2) 免疫動物的選擇。根據所用的骨髓瘤細胞可選用小鼠和大鼠作為免疫動物。因為,所有的供雜交瘤技術用的小鼠骨髓瘤細胞系均來源於BALB/c小鼠,所有的大鼠骨髓瘤細胞都來 源於LOU/c大鼠,所以一般的雜交瘤生產都是用這兩種純系動物作為免疫動物。但是,有時為了特殊目的而需進行種間雜交,則可免疫其他動物。種間雜交瘤一 般分泌抗體的能力不穩定,因為染色體容易丟失。就小鼠而言,初次免疫時以8-12周齡為宜,雌性鼠較便於操作。
(3) 免疫程式的確定。免疫是單抗製備過程中的重要環節之一,其目的在於使B淋巴細胞在特異抗原刺激下分化、增殖,以利於細胞融合形成雜交細胞,並增加獲得分泌特異性抗體的雜交 瘤的機會。因此在設計免疫程式時,應考慮到抗原的性質和純度、抗原量、免疫途徑、免疫次數與間隔時間、佐劑的套用及動物對該抗原的應答能力等。沒有一個免 疫程式能適用於各種抗原。現用的免疫程式中多數是參照製備常規多克隆抗體的方法。表6-1列舉了目前常用的免疫程式。免疫途徑常用體內免疫法包括皮下注 射、腹腔或靜脈注射,也採用足墊、皮內、滴鼻或點眼。最後一次加強免疫多採用腹腔或靜脈注射,目前尤其推崇後者,因為可使抗原對脾細胞作用更迅速而充分。 在最後一次加強免疫後第3天取脾融合為好,許多實驗室的結果表明,初次免疫和再次免疫應答反應中,取脾細胞與骨髓瘤細胞融合,特異性雜交瘤的形成高峰分別為第4天和第22天,在初次免疫應答時獲得的雜交瘤主要分泌IgM抗體,再次免疫應答時獲得的雜交瘤主要分泌IgG抗 體。筆者體會陽性雜交瘤出現的高峰與小鼠血清抗體的滴度並無明顯的平行關係,且多在血清抗體高峰之前。因此,為達到最高的雜交瘤形成率需要有儘可能多的漿 母細胞,這在最後一次加強免疫後第3天取脾進行融合較適宜。已有人報導採用脾內免疫,可提高小鼠對抗原的免疫反應性,且節省時間,一般免疫3天后即可融合。
細胞融合
首先製備細胞培養基、 氨基喋呤(A)貯存液、次黃嘌呤和胸腺嘧啶核苷(HT)貯存液等各種細胞生長所需的營養物質。然後製備髓瘤細胞和脾淋巴細胞,之後進行細胞融合。在細胞融合後選擇性培養過程中,由於大量骨髓瘤細胞和脾細胞相繼死亡,此時單個或少數分散的雜交瘤細胞多半不易存活,通常必須加入其他活細胞使之繁殖,這 種被加入的活細胞稱為飼養細胞。飼養細胞促進其他細胞增殖的機制尚不明了,一般認為它們可能釋放非種屬特異性的生長刺激因子,為雜交瘤細胞提供必要的生長 條件;也可能是為了滿足新生雜交瘤細胞對細胞密度的依賴性。
細胞篩選
雜交瘤細胞在融合後2周左右即可篩選,即把分泌所需抗體的雜交瘤孔從眾多的孔中選出來,通常也稱為抗體檢測。抗體檢測的方法很多,通常根據所研究的抗原和 實驗室的條件而定。但作為雜交瘤篩選的抗體檢測方法必須具有快速、準備、簡便,便於一次處理大量樣品等特點。因為往往有幾百個樣品需要在短短几個小時就報 告結果,以便決定雜交瘤細胞的取捨。所以選用抗體檢測方法的原則是快速、敏感、特異、可靠、花費小和節省人力。一般說來,在融合之前就必須建立好抗體檢測 方法,並克服可能存在的問題。另一個重要問題是抗體檢測方法所需要的“動力學範圍”,即檢出背景以上的最強與最弱信號之比,依所用的檢測抗原是否純淨而 定。如雜交瘤抗體是針對純化的蛋白質抗原的,100%的抗原參與反應,一個陽性/陰性判別系統就夠了。另一方面,如果雜交瘤抗體是針對細胞表面微量的蛋白 抗原,檢測系統可能需要能測出微弱信號,則動力學範圍至少應為10:1,最好為100:1。另外,檢測方法的選擇還受所需雜交瘤抗體的類型和預定的用途的 影響。結合補體的抗體可以用基於細胞毒性反應的檢測方法來選出。如需結合A蛋白的雜交瘤抗體,就要用結合蛋白A的檢測方法。
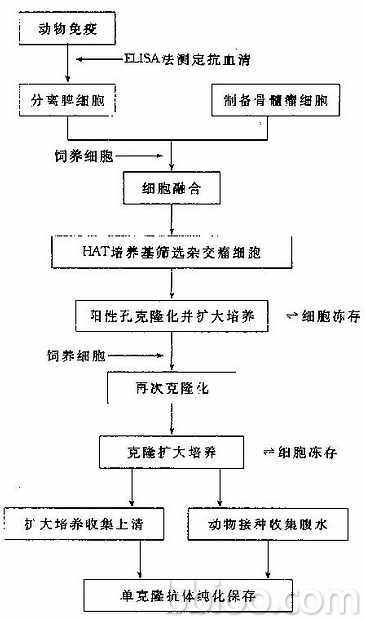
克隆化
從原始孔中得到的陽性雜交瘤細胞,可能來源於二個或多個雜交瘤細胞,因此它們所分泌的抗體是不同質的。為了得到完全同質的單克隆抗體,必須對雜交瘤細胞進 行克隆化。另一方面,雜交瘤細胞培養的初期是不穩定的,有的細胞丟失部分染色體,可能喪失產生抗體的能力。為了除去這部分已不再分泌抗體的細胞,得到分泌 抗體穩定的單克隆雜交瘤細胞系(又稱亞克隆),也需要克隆化。另外,長期液氮凍存的雜交瘤細胞,復甦後其分泌抗體的功能仍有可能丟失,因此也應作克隆化, 以檢測抗體分泌情況。通常在得到針對預定抗原的雜交瘤以後需連續進行2-3次克隆化,有時還需進行多次。所謂克隆化是指使單個細胞無性繁殖而獲得該細胞團 體的整個培養過程。克隆化的方法很多,如有限稀釋法、軟瓊脂法、單細胞顯微操作法、單克隆細胞集團顯微操作法和螢光激活細胞分類儀(FACS)分離法。
凍存與復甦
(1)雜交瘤細胞的凍存。在建立雜交瘤細胞的過程中,有時一次融合產生很多“陽性”孔,來不及對所有的雜交瘤細胞作進一步的工作,需要把其中一部分細胞凍存起來;另一方面,為了防 止實驗室可能發生的意外事故,如停電、污染、培養箱的溫度或CO2控制器失靈等給正在建立中的雜交瘤帶來災難,通常儘可能早地凍存一部分細胞作為種子,以 免遭到不測。在雜交瘤細胞建立以後,更需要凍存一大批,以備今後隨時取用。
(2)雜交瘤細胞的復甦。雜交瘤細胞、骨髓瘤細胞或其他細胞在液氮中保存,若無意外情況時,可保存數年至數十年。復甦時融解細胞速度要快,使之迅速通過最易受損的-5℃—0℃,以防細胞內形成冰晶引起細胞死亡。
鑑定單抗特性
⑴ 單克隆性的確定 包括雜交瘤細胞的染色體分析、單抗免疫球蛋白重鏈和輕鏈類型的鑑定和單抗純度鑑定等。
⑵ 單抗理化特性的鑑定。從實用意義上說,單抗對溫度和PH變化的敏感性以及單抗的親合力都是理化特性鑑定的主要項目,它們可為單抗的使用和保存提供重要依據。
⑶ 單抗與相應抗原的反應性測定。單抗與相應抗原的反應性決定於它所識別的抗原表位,確定單抗針對的表位在抗原結構上的位置,是單抗特性鑑定的關鍵環節,同時,進一步分析這類表位的差別, 可正確評價單抗的特異性和交叉反應性。
特點
一是
特異性,針對特定的單一抗原表位,它具有高度的特異性,抗腫瘤抗體藥物的研究表明,其特異性主要表現為特異性結合、
選擇性殺傷靶細胞、體內靶向性分布以及具有更強的療效。
二是多樣性,主要表現在靶抗原的多樣性、抗體結構的多樣性、作用機制的多樣性等方面。
三是定向性,抗體藥物可以定向製造,就是根據需要製備具有不同治療作用的抗體藥物。基於這些特點,我們可以用來製成“生物飛彈”運送藥物至病害部位,主要是癌細胞,從而達到治療效果。
類型
鼠源性抗體
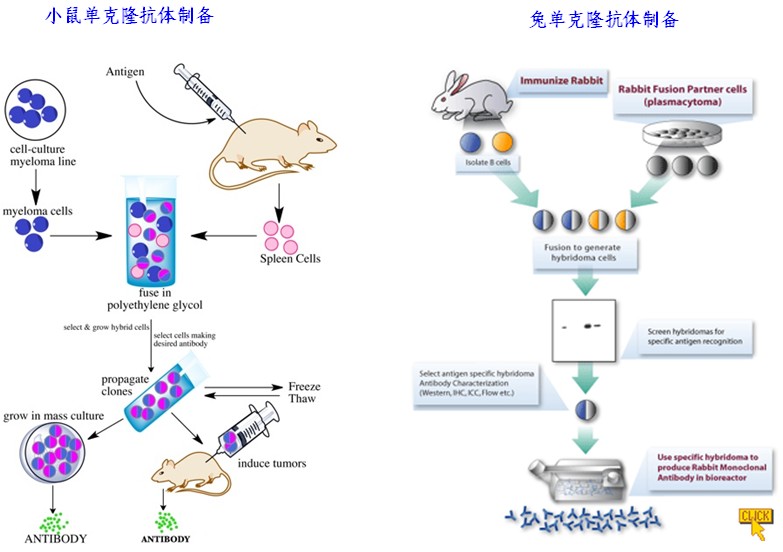
雜交瘤單克隆抗體製備技術的基本原理是利用聚乙二醇作為細胞融合劑,使免疫的小鼠脾細胞與具有不斷繁殖能力的小鼠骨髓瘤細胞在體外進行融合,在HAT選擇性培養基的作用下,只讓融合成功的雜交瘤細胞生長,經過反覆的免疫學檢測篩選和單個細胞培養(克隆化),最終獲得既能產生所需單克隆抗體,又能不斷繁殖的雜交瘤細胞系,將這種細胞擴大培養,接種於小鼠腹腔,在其產生的腹水中即可得到高效價的單克隆抗體。由於單抗的套用是從體外診斷向體內腫瘤定位和治療方向發展,故鼠源性單抗出現了難以克服的缺點,特別是在體內套用時,存在主要組織相容性抗原(MHC)和超敏反應問題。隨著鼠源單克隆抗體在臨床治療中越來越廣泛的套用,降低抗體免疫原性的要求也變得越來越迫切。為了克服這一問題科學家利用基因工程方法使小鼠的抗體人源化。通過構建人一鼠嵌合抗體,在一定程度上減弱了人抗鼠抗體。
人鼠嵌合抗體
為了克服鼠源性單克隆抗體存在的問題,科學家利用基因工程方法使小鼠的抗體人源化。通過構建人一鼠嵌合抗體,在一定程度上減弱了人抗鼠抗體。1984年Morrison等人成功地構建了第一個人鼠單克隆抗體即嵌合抗體。嵌合抗體指的是鼠單克隆抗體的恆定區基因被人抗體的恆定區基因通過基因重組技術所替換而編碼並在合適的宿主細胞中表達而產生的單克隆抗體。
基本原理:抗體分子的特異性識別、抗原結合由輕鏈和重鏈可變區決定的,而異源蛋白產生的人抗鼠抗體反應的主要是抗體恆定區。將小鼠單抗恆定區用人源化恆定區代替而拼接成嵌合抗體,使其重鏈和輕鏈的可變區來自小鼠,恆定區來自人類。簡言之嵌合抗體既具有抗原結合特異性,又大大地降低了鼠單抗的異源性。嵌合抗體是基因工程抗體最早研究出來的一種抗體,在腫瘤治療和診斷方法已被廣泛的套用。雖然嵌合抗體在一定程度上減弱了人抗鼠抗體反應,但仍存在一少部分鼠源成分。這直接導致抗體被迅速清除,從而降低治療效果。
人源化抗體
1.改形抗體
1986年,Jones等人成功構建了第一個改形抗體,又稱CDR移植抗體和人源化抗體,指將鼠單抗可變區中互補決定區(CDR)序列取代人源抗體相應CDR序列,重組構成既具有鼠源性單抗特異性,又保持人抗體親和力的CDR移植抗體。迄今為止,已有100多種鼠單抗通過CDR移植得到了人源化。基本原理:抗體重鏈和輕鏈的可變區主要由CDR和骨架區(FR)組成。其中可變區的6個CDR是負責識別和結合抗原的區域,它們直接與抗原接觸,決定了抗體的特異性。骨架區是可變區以外的其它部分,主要起著支持CDR的作用,而且它們的胺基酸組成和排列相對不易改變,因此,可以將鼠單抗的CDR移植到人單抗的骨架區,就有可能使人單抗獲得鼠單抗一樣的抗原特異性,並可以最大限度地降低鼠單抗的異源性,這樣就得到了改形抗體。與嵌合抗體相比,改形抗體進一步減少了抗體中鼠源部分的比例,降低了人抗鼠抗體,但仍有抗體可能導致抗獨特型抗體的產生且存在一些局限性,例如構建方法相對複雜,操作起來費時費力;抗體的晶體結構以及電腦模擬抗體的微細結構上都有很大的問題;降低免疫原性和保持抗原結合活性方面還有很多問題。理所當然,尋找既能實現人源化又可以保持高的免疫學活性的簡單易行方法勢在必行。
2.表面胺基酸殘基人源化一一鑲面抗體
1991年由Padlan提出的與CDR移植完全不同的降低鼠源抗體免疫原性的方法。[9]其理論依據是分析了大量鼠單抗可變區和人單抗可變區胺基酸殘基的表面暴露情況,結果發現這些暴露的胺基酸殘基位置和數量都非常保守,不因為種屬和型別而改變。研究表面,這些暴露的胺基酸殘基是鼠源可變區免疫原性的主要來源。將鼠單抗可變區表面暴露的骨架區胺基酸殘基中與人可變區相應的胺基酸殘基改為人源的,就可以使可變區表面人源化,消除了異源性而不影響可變區的整體空問構象。
3.表位印記選擇
表位印記選擇指的是一種與高效篩選噬菌體抗體庫技術相結合的人源化抗體的方法,可以通過數論篩選就能得到完全人源的抗體。基本原理:鼠單抗的一個重鏈或者輕鏈可變區基因與人源抗體的重鏈或者輕鏈的可變區基因文庫配對,得到雜合的人鼠抗體庫。藉助噬菌體抗體庫的高效篩選方法,能迅速得到所需抗體,比CDR移植簡單且能得到真正的人抗體。缺點:篩選工作量特別大。
小分子抗體
小分子抗體顧名思義是分子量較小的抗體片段,它的抗體分子的抗原結合部位僅僅局限於重鏈和輕鏈的可變區。雖然分子很小但它既保持了親本單抗的親和力具有親本單抗一樣的特異性。種類主要包括:抗原結合片(Fab)抗體、Fv抗體、單鏈抗體、單域抗體與最小識別單位。
1.Fab抗體
Fab抗體為僅含Fab分子,Fab段由完整的輕鏈(恆定區CL和可變區VLCL)和重鏈Fd段(第一恆定區CH1和可變區VH)通過一個二硫鍵連線形成異二聚體,整個分了大小約占總抗體的三分之一,僅含有一個抗原結合位點。將完整輕鏈和重鏈Fd的編碼基因進行連線,可在大腸桿菌中表達,形成完整的二硫鍵和立體摺疊,可以保存Fab斷的功能。常被用於實驗室的研究工具。
2.Fv抗體
Fv抗體僅由輕鏈和重鏈的可變區組成通過非共價鍵連線,是抗體分了保留完整抗原結合部位的最小功能片段。該片段由於是通過非共價鍵連線的,所以穩定性不好,十分容易解離。採用適當的方法來解決Fv片段穩定性問題。
3.單鏈抗體
單鏈抗體的問世解決了Fv抗體的穩定性問題。它由適當的寡核普酸序列將輕鏈和重鏈可變區連線而成,形成單一鏈的分子,故稱為單鏈抗體。就是單一鏈的結構大大增加了Fv片段的穩定性。相對完全抗體而言,單鏈抗體在臨床上作為治療劑有好多優越性。但它也有親和力下降等缺點。
4.單域抗體
單域抗體僅含重鏈可變區,結構比Fv的亞單位還小,它是一個具有抗原結合活性的分子。同完整抗體相比,單域抗體仍然具有與抗體結合的同等能力及穩定性。
5.最小識別單位
比單域抗體還小的最小識別單位僅含可變區中單一CDR結構,分子量十分小僅占完全抗體的1%左右,親和力也相當低,所以被命名為最小識別單位。雖然最小識別單位分子量小、親和力低,但是它具有與抗原結合的能力。
人源性抗體
從最初的鼠源單抗技術到人源化技術,單克隆抗體在幾十年的歲月中取得了突飛猛進的發展。人源化的問世使單克隆抗體基本解決了人抗鼠源性問題。但有用人源化的抗體基因均來自雜交瘤細胞。雜交瘤的這個操作過程很複雜且耗時加之利用雜交瘤技術難以製備自身抗原抗體和全人源抗體,這兩大缺點成為基因工程抗體套用的絆腳石。隨著科學技術的不斷進步單克隆抗體進入了一個嶄新的發展階段一一人源性單克隆抗體。它主要包括噬菌體抗體庫技術、轉基因小鼠製備人源性抗體、核糖體展示技術三部分。
臨床套用
疾病診斷
利用單抗進行疾病的診斷目前主要表現在人類疾病和畜禽傳染病的診斷方面,尤其在一些感染性疾病和腫瘤的診斷方面。主要通過鑑定病原體或腫瘤抗原來診斷人是否感染相應疾病。
疾病治療
目前利用單抗對疾病進行治療已取得了很大的成果,主要是將單抗同藥物耦聯,再與病原體或腫瘤的特異抗原結合後發揮作用。
食品衛生
目前,單克隆抗體技術在食品生產加工以及科學研究中得到廣泛的套用,食品基質中的細胞、大分子聚合物的小分子半抗原物質均能通過單克隆技術研究或檢出。 如,用單克隆抗體技術快速檢測食品中的農獸藥。單克隆抗體在乳品工業中主要用於牛奶成分分析,尤其對非正常風味牛奶的微生物與酶的鑑定;牛奶中的病原微生物和毒素的檢測;加工工藝對牛奶蛋白結構的影響以及牛奶中摻物的識別。
 單克隆抗體技術
單克隆抗體技術

 單克隆抗體技術
單克隆抗體技術

