基本介紹
- 中文名:原子質量
- 外文名:Atomic mass
- 質量單位:千克
- 相關概念:相對原子質量
- 鐵原子質量:9.288×10-26kg
- 學科:化學
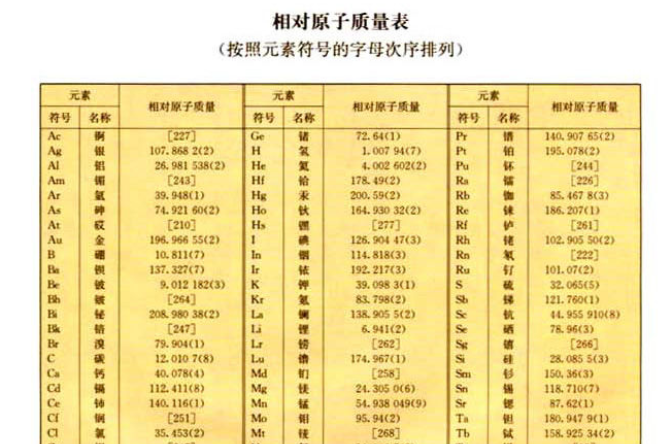
原子質量分為絕對原子質量和相對原子質量。絕對質量指的是1個原子的實際質量,也可以叫做原子的絕對質量。相對原子質量是原子的相對質量,即以一種碳原子(原子核內有...
本相對原子質量表按照原子序數排列。 本表數據源自最近元素周期表(IUPAC 2005 standard atomic weights),以12C=12為標準。 本表方括弧內的原子質量為放射性元素的...
為準確計量微小分子的重量,國際通常採用一個原子的質量單位為基準,定義為碳12元素原子質量的1/12為一個原子質量單位。
由於原子的實際質量很小,如果人們用它們的實際質量來計算的話那就非常的麻煩,例如一個氫原子的實際質量為1.674×10⁻²⁷千克,一個氧原子的質量為2.657×...
原子質量數是指一個原子核中含有的質子和中子的總數。通常以A表示,寫在元素符號的左上角。原子質量數是無單位的。嚴格地講,原子質量數所表示的質量並不等於原子...
人們為了紀念道爾頓,以他的名字作為原子質量單位。在生物化學、分子生物學和蛋白組學中經常用D或KD,定義為碳12原子質量的1/12,1D=1 g/mol。...
1803年道爾頓首先提出,以氫原子質量為1作為原子量的標準--絕對質量。用比較的方法測定其他元素原子的相對質量(氫是已知的密度最小的元素,這樣別種元素的原子量皆...
相對論中,物體的質量不再是絕對量,而與物體的運動緊密聯繫在一起。經典力學中的“絕對質量”稱為靜止質量,用m0表示。當測量相對於觀測者有高速運動的物體時,得到...
《原子質量計算器》是一款IOS平台的套用,支持iOS3.0及以上版本。...... 原子質量計算器(AMC)是一種很有用的工具,任何人都需要計算分子質量迅速和容易。這是一個...
相對分子質量(Relative molecular mass),即是指化學式中各個原子的相對原子質量(Ar)的總和,用符號Mr表示,單位是1。對於聚合物而言,其相對分子量可達幾萬甚至幾...
氫是一種化學元素,在元素周期表中位於第一位。氫通常的單質形態是氫氣。它是無色無味無臭,極易燃燒的由雙原子分子組成的氣體,氫氣是最輕的氣體。醫學上用氫氣...
鋅是一種化學元素,它的化學符號是Zn,它的原子序數是30,在化學元素周期表中位於第4周期、第ⅡB族 。鋅(Zinc)是一種淺灰色的過渡金屬,也是第四"常見"的金屬,...
鈾(Uranium)的原子序數為92的元素,其元素符號是U,是自然界中能夠找到的最重元素。在自然界中存在三種同位素,均帶有放射性,擁有非常長的半衰期(數億年~數十億年...
