基本介紹
- 中文名:化學位移
- 外文名:chemicalshift
- 表示:相對數值表示法
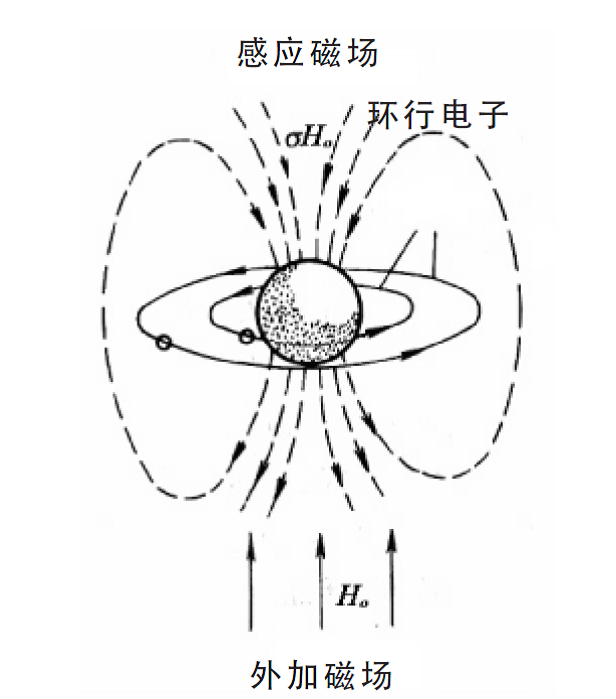
產生原因
公式表示
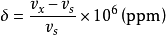
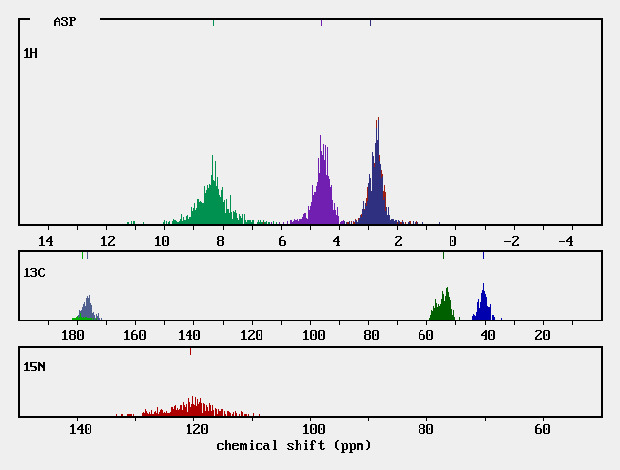

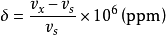
在有機化合物中,處在不同結構和位置上的各種氫核周圍的電子云密度不同,導致共振頻率有差異,即產生共振吸收峰的位移,稱為化學位移。 [1] ...
位移試劑一般用在分辨手性化合物(enantiomers )的混合物。位移試劑本身是一種純手性化合物。在溶液里它與被分析的手性混合物中的兩種成分(左手,右手成分,它們的化學...
在外電磁場的感應下產生不同程度的禁止作用,這種禁止作用使原子核實際受到的磁場略有降低,因而在核磁共振譜的不同位置上出現吸收峰,這種位置的差異稱為化學位移。...
《核磁共振譜學—在有機化學中的套用(第三版)》是2015年6月出版的圖書,作者是王乃興。...
《核磁共振譜學:在有機化學中的套用》論述了NM日譜學的內容,作者主要參閱了近幾年來國外這方面的文獻,對氫譜、碳譜、二維譜、蛋白質和核酸的NM日分析等問題作...
苷化位移(glycosidation shift):糖與苷元成苷後,苷元的α-C、β-C和糖的端基碳的化學位移值均發生了改變,這種改變稱為苷化位移。...
鑭系元素位移試劑;lanthanide shift reagent性質:一類如結構式所示的配位化合物,式中M=Eu、Pr、Yb等,常簡寫為Eu(tfc)、即Tris [3-(trifluoromethylhydroxymethylene...
1 簡介 2 化學位移 3 另見 核磁共振氫譜簡介 編輯 核磁共振氫譜(也稱氫譜) 是一種將分子中氫-1的核磁共振效應體現於核磁共振波譜法中的套用。可用來確定...
TMS是一種化學物質,分子式是(CH3)4Si。...... 四甲基矽烷在核磁共振波譜的1H、13C和29Si譜中起到標定化學位移零點的作用。因為四甲基矽烷的12個氫是相同的,4...
ppm化學位移量 編輯 核磁共振中,由於原子核所處化學環境的不同,它們所受的禁止作用不同,而使理論上的核磁單一共振信號出現多峰信號分化,即核磁共振信號出現在不...
由於這個原因,苯環氫的化學位移數值比烯氧大。3)化學鍵的各向異性禁止作用化學鍵無論是單鍵、雙鍵還是叄鍵,都具有各向異性的禁止作用。也就是說它們對於不同方向...
《NMR核磁共振》2009年化學工業出版社出版的一本圖書,作者是喬梁。...... 4?1化學位移4?2偶合常數4?3圖譜分析參考文獻第5章核磁共振碳譜5?113C?NMR的特點...
氫的核磁共振譜提供了三類極其有用的信息:化學位移、偶合常數、積分曲線。套用這些信 息,可以推測質子在碳胳上的位置。根據前面討論的基本原理,在某一照射頻率下,...
碳譜與氫譜的基本原理相同,化學位移定義及表示方法與氫譜一致 。所以內標物也與氫譜相同, 統一用TMS作為碳譜化學位移的零點。影響碳譜化學位移的因素很多,主要有...
在液體樣品中,分子的快速運動將導致核磁共振譜線增寬的各種相互作用(如化學位移各向異性和偶極-偶極相互作用等)平均掉,從而獲得高分辨的液體核磁譜圖;對於固態樣品,...
