天然毒蛋白的一種,富含於眼鏡蛇毒的毒液中。屬酸性分泌性磷脂酶。具有多種藥理學活性和較高的臨床套用價值。
基本介紹
- 中文名:眼鏡蛇毒磷脂酶A2
- 外文名:cobra venom Phospholipase A2
- 分子量:13-14 ku
- 所屬學科:生物化學與分子生物學
- 等電點:6.3
簡介,理化性質,化學性質,生化特性,分離提純,分子結構,晶體結構,構象,空間結構,毒理學,毒物作用模式,對血液系統的作用,神經毒性,肌肉骨骼毒性,心臟毒性,致炎症作用,其他作用,醫學作用,
簡介
眼鏡蛇毒是由眼鏡蛇的毒液腺分泌出的一種天然毒蛋白,化學成分非常複雜,含有多種蛋白質、多肽、酶類和其他非蛋白類小分子物質,具有廣泛的生物學活性。眼鏡蛇毒磷脂酶A2是蛇毒液中含量較為豐富的組分,由於其具有多種藥理學活性和較高的臨床套用價值,得到了廣泛的關注和深入的研究。
磷脂酶A2(Phospholipase A2,PLA2)是一類分布廣泛的酶家族,存在於各種動物組織,尤其在蛇毒、蠍毒、蜂毒等動物的毒液和哺乳動物的胰臟分泌液中。按其分子量、生物來源和對Ca2+的要求及其它生化特性大致可分為4類:分泌型PLA2 (sPLA2),胞質型PLA2( cPLA2),細胞內PLA2( iPLA2)以及一些其它PLA2家族,如PAF等。雖然PLA2各個亞型的結構和功能存在許多不同,但它們都具有一種共同的基本作用,即以生物膜磷脂為天然底物,催化甘油磷脂sn-2位上的醯鍵發生水解反應,產生溶血磷脂和脂肪酸,參與磷脂的代謝。蛇毒磷脂酶A2在結構和水解功能上與哺乳動物的分泌型PLA2非常相似,但其還具有某些重要的毒性作用(如神經毒性、出血毒性、肌肉毒性、心臟毒性等)及多種其他生物學功能(如殺菌、誘導細胞凋亡、阻止HIV 進入宿主細胞、引起水腫等)。
理化性質
化學性質
眼鏡蛇毒磷脂酶A2又稱為14kuPLA2或低分子PLA2,其超家族有很多成員,如Ⅰ型PLA2(分A、B兩個亞型),Ⅱ型PLA2(分A、B、C、D、E、F 6個亞型),以及Ⅴ、Ⅸ、Ⅹ、Ⅺ、Ⅻ型PLA2,廣泛地存在於多個物種內。其中ⅠA型PLA2主要來自眼鏡蛇毒,分子量為13-14 ku,分子內含7個二硫鍵,而ⅠB型PLA2主要來自哺乳動物胰腺、肺和脾,分子量為14 ku, 含7個二硫鍵。這兩者都具有典型的Ⅰ型PLA211位和77位的特徵二硫鍵。由於分子內含較多的二硫鍵,結構中具有兩歧性胺基酸末端α螺旋、鈣結合襻和活性位點,使它們具有熱穩定性,同時也需要鈣激活。另外,Ⅱ型PLA2有一附加的二硫鍵連線在C螺旋中部和超長尾(6或7個殘基)的C末端上,但Ⅰ型PLA2僅有一個短的D螺旋。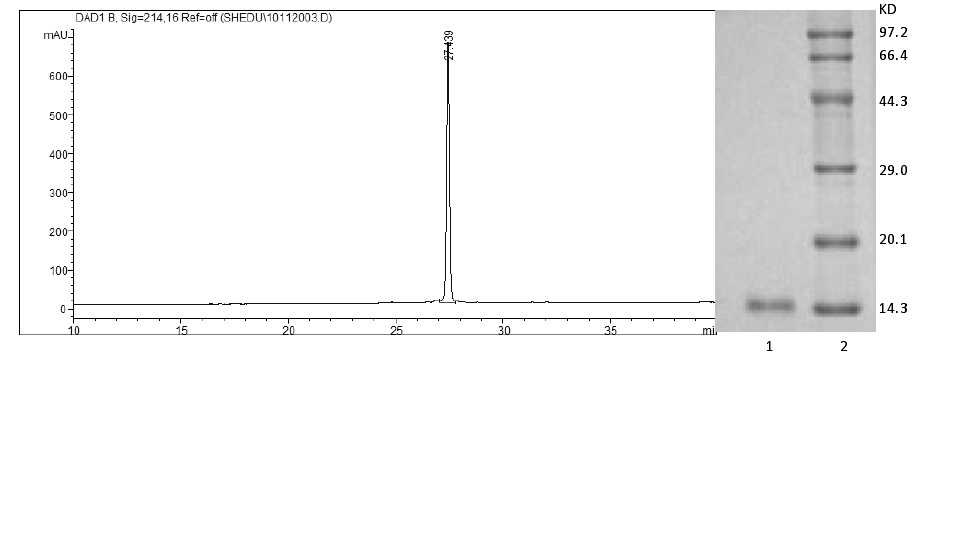 舟山眼鏡蛇毒磷脂酶HPLC及SDS凝膠電泳圖
舟山眼鏡蛇毒磷脂酶HPLC及SDS凝膠電泳圖
 舟山眼鏡蛇毒磷脂酶HPLC及SDS凝膠電泳圖
舟山眼鏡蛇毒磷脂酶HPLC及SDS凝膠電泳圖舟山眼鏡蛇毒磷脂酶HPLC及SDS凝膠電泳圖冊參考資料。
眼鏡蛇毒PLA具有高度同源的一、二、三級結構。等電點為6.3,因此,屬於酸性PLA2。胺基酸組分分析表明富含Asp、Ala、Gly、Cys,約由126個胺基酸組成。糖含量分析表明此酶不含糖基,為單純蛋白。
生化特性
眼鏡蛇毒磷脂酶A2在結構和水解功能上與哺乳動物的分泌型PLA2非常相似。然而,除了具有與哺乳動物PLA2相同水解催化活性之外,蛇毒PLA2還具有某些重要的毒性作用,如神經毒性,出血毒性,肌肉毒性,心臟毒性等。在PLA2分子上除了酶活性部位以外,還存在一個藥理活性部位,能夠引導PLA2到達並識別各自的目標組織和細胞,並且與靶細胞膜上的特異性受體相結合,從而發揮不同的藥理作用。已經有280種PLA2的胺基酸序列得到了測定。儘管它們的藥理學性質不盡相同但是其胺基酸序列的同源性達到了40%-99%,而且其空間結構也極為相似。根據PLA2的一級結構和二硫鍵排列方式的不同,蛇毒PLA2可分為兩類:第一類主要分布在眼鏡蛇科和海蛇科蛇毒中,第二類分布在蝰蛇科蛇毒中。根據PLA2第49 位胺基酸的不同,第二類PLA2又可進一步分為Asp49 PLA2(D49 PLA2)和Lys49 PLA2(K49 PLA2),前者能與Ca2+結合而具有酶活性,後者則由於Lys49替換Asp49,不能與Ca2+結合而喪失酶活性或酶活性很低。一般來說,同一種蛇毒中含有不止一種PLA2,有的還同時包括D49PLA2和K49PLA2,它們來源於同一個祖先分子,並通過基因重複和加速進化產生,在這個過程中它們可能發生了功能分化,但是還沒有證據證實第二類PLA2哪些位點的變化導致了功能分化。不同來源的PLA2酶活性差別很大,即使同一蛇中分離得到的不同PLA2的酶活性也可能相差很大。例如從江浙蝮蛇分離到的三種磷脂酶,即酸性,鹼性及中性PLA2當以卵磷脂為底物時,其相對酶活力的大小順序是酸性>中性>鹼性,當底物是磷脂酸時,酶活性大小則是鹼性>中性>酸性,此外,對於Lys49-PLA2而言,其對人工底物都不具有PLA2活力,但將其加入細胞培養物中,能導致生成由膜磷脂水解產生的脂肪酸。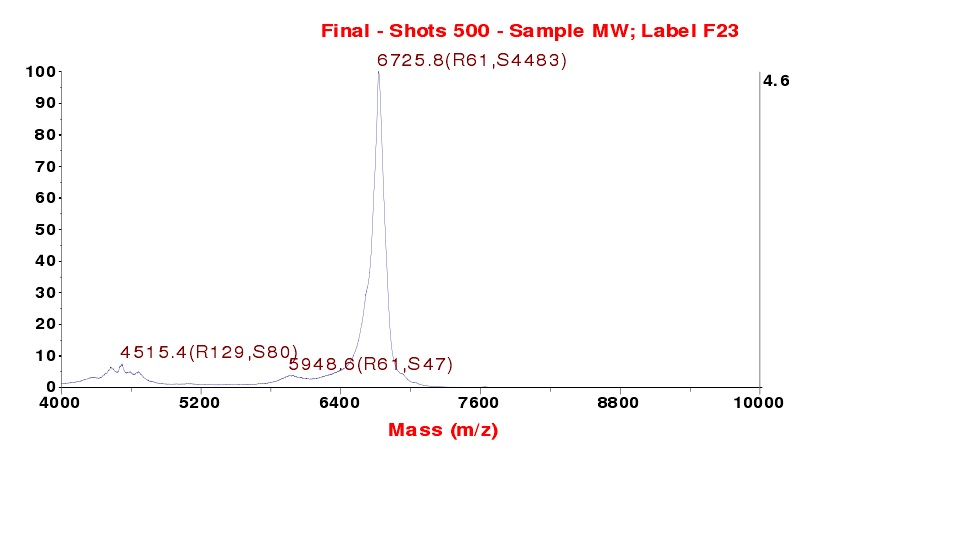 舟山眼鏡蛇毒磷脂酶質譜圖
舟山眼鏡蛇毒磷脂酶質譜圖
 舟山眼鏡蛇毒磷脂酶質譜圖
舟山眼鏡蛇毒磷脂酶質譜圖PLA2是一種特別的水解酶,其自身是水溶性的,但卻可以水解不溶於水的磷脂底物。它們可以水解單體、微團或脂質雙分子層。當磷脂單體在臨界濃度聚集成微團時,PLA2的催化活性可大大提高,這種界面激活現象在PLA2中很常見。界面識別位點是催化活性位點以外的位點,對於這種結合於極性水相和非極性磷脂之間的界面的特殊性質以及界面激活作用很重要。雖然,PLA2對磷脂基團具有一定的選擇性,但其催化活性主要是由反應複合物的物理性質決定的,如堆積密度、相變溫度、磷脂晶型或其他分子的存在。
眼鏡蛇毒PLA2不僅具有酶活性,其本身還可作為配基與相應的受體結合而發揮生物學功能。眼鏡蛇毒PLA2與一些特殊蛋白有較高的親和力,故能夠靶向定位於一些特殊的組織器官上,這一靶向結合方式是因為在PLA2表面存在著一個與催化活性位點無關的“藥理作用位點”。已知有兩種眼鏡蛇毒PLA2受體:M型受體和N型受體,分別分布於骨骼肌和神經系統。
用基因克隆方法對眼鏡蛇毒PLA2測序,可為研究其構效關係和蛇傷中毒機制打下良好基礎。雖然在晶體結構研究中對與眼鏡蛇毒sPLA2活性有關的結構部位作了一些推測,但最終要確定這部分結構,還得寄希望於對眼鏡蛇毒PLA2基因的定位突變的研究,其難點之一是需要高效表達該蛋白質的基因。用pET28a-酸性PLA2-Ⅰ轉化大腸桿菌BL21時,因為pET28 a(+)是融合型表達載體,故表達的蛋白較穩定,復性後仍具有一定的酶活性和血小板聚集作用,但由於表達蛋白在N端融合了6個Histag及24個胺基酸,表達的PLA2-Ⅰ的分子量略大於原有的14 ku的分子量,所以尚需繼續尋求更適合的表達方法。
分離提純
獲得單一的活性成分是對其進行理化性質分析、藥理活性檢測和臨床套用的前提。傳統的眼鏡蛇蛇毒分離純化方法過程繁複,耗時較長,而且一般僅套用於實驗室,工藝較難放大用於規模化生產。主要用色譜柱分離提取眼鏡蛇毒PLA2,且得到的多為Ⅰ型PLA2。例如將廣西眼鏡王蛇的粗毒用SephadexG-75凝膠柱過濾,再經CM-Sepha-rase CL-6B和DEAE-SephadexA-50離子交換,可得Ⅰ型PLA2。用CM-Sephadex C-50、DEAE-Sepha-dexA-50和SephadexG-75依次洗脫,分離純化中華眼鏡蛇毒能得一分子量為14 ku的sPLA2。國外也多採用連續柱層析法,如用CM-Sephadex C-50離子交換和SephadexG-50凝膠過濾提純印度眼鏡蛇粗毒也得到了PLA2-Ⅰ和另一種具有更強的膜磷脂水解作用的亞型PLA2:PLA2-Ⅱ。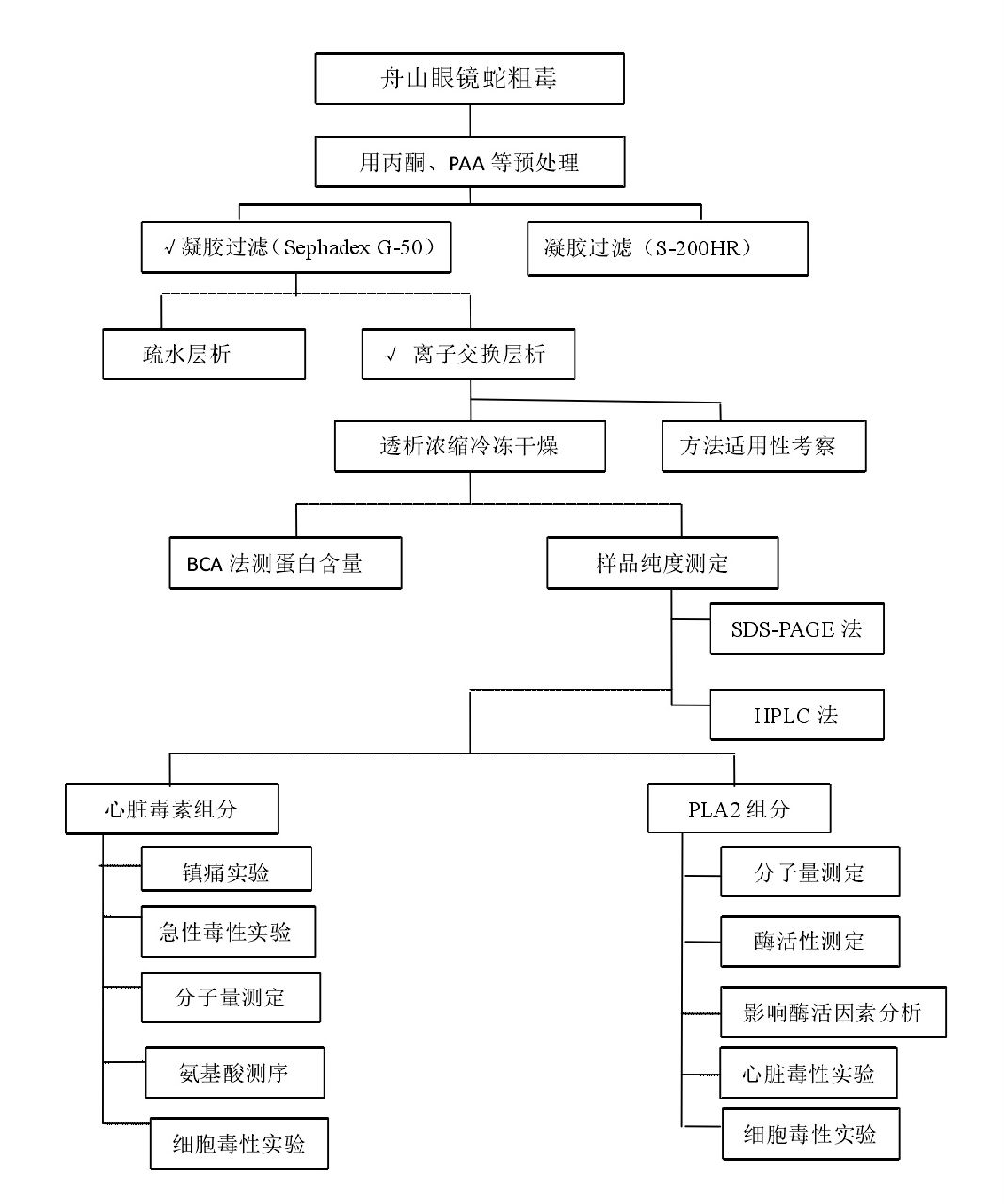 眼鏡蛇毒磷脂酶分離純化示意圖
眼鏡蛇毒磷脂酶分離純化示意圖
 眼鏡蛇毒磷脂酶分離純化示意圖
眼鏡蛇毒磷脂酶分離純化示意圖一些舊的純化途徑如熱和pH 值沉澱法、乙醇分餾法、鹽析法、超高速離心法等分離效率很低,而且這些途徑中使用的極端的pH值、溫度和一些特殊的溶劑常不利於有效成分活性的保持。常用的一些新的分離方法有葡聚糖凝膠層析,分子篩層析,離子交換層析,丙烯醯胺凝膠電泳(主要用於蛇毒成分的鑑別)和等電聚焦電泳(常用於測定蛇毒各種成分的等電點)等,另外一些更先進的分離技術也很吸引人們的注意,如疏水層析,免疫親和層析,共價作用親和層析,金屬螯合親和層析,徑向膜色譜法及各種膜技術等,它們對於蛇毒中活性成分的分離純化也有很大的套用價值。
分子結構
晶體結構
眼鏡蛇毒PLA2晶體I屬於422點群。按P422進行處理,其Rmerge統計為0.105,晶胞參數為:a=b=8.797 nm,c=10.831 nm。由於00L和H00有系統消光(衍射條件L=4n,H=2n),因此,空間群為P43212或P41212。眼鏡蛇毒PLA2晶體II屬於23點群。按P23進行處理,晶胞參數為a=b=c=6.840 nm。由於H00有系統消光(衍射條件H=2n),因此推斷其空間群為P213。晶體衍射解析度為0.28 nm,合併後的數據完整度為99%,Rmerge為0.089。
眼鏡蛇毒PLA2屬於I型PLA2,已測定出眼鏡蛇毒的兩種PLA2的三維結構即印度眼鏡蛇(Naja naja naja)毒PLA2和台灣眼鏡蛇毒PLA2晶體結構,由於蛋白質結晶性能與其胺基酸序列及三維結構緊密相關,結晶性能的相似與差異可能反映了分子結構的相似與差異。就晶體特性而言,廣西眼鏡蛇毒PLA2與印度眼鏡蛇毒PLA2非常近似,與台灣眼鏡蛇毒PLA2顯著不同。從地域角度看,由於中國與印度次大陸緊密相連,廣西眼鏡蛇與印度眼鏡蛇雖然不是同一種屬,分子結構相似是可理解的;而由於海洋阻隔,廣西眼鏡蛇與台灣眼鏡蛇種屬PLA2分子結構差別自然會大一些。有報導說,產於舟山群島和福建省等地的舟山眼鏡蛇(Naja naja atraCantor)與台灣眼鏡蛇(Najanaja atra)屬同一蛇科,。這些都說明從分子結構水平可深入了解蛇的進化問題。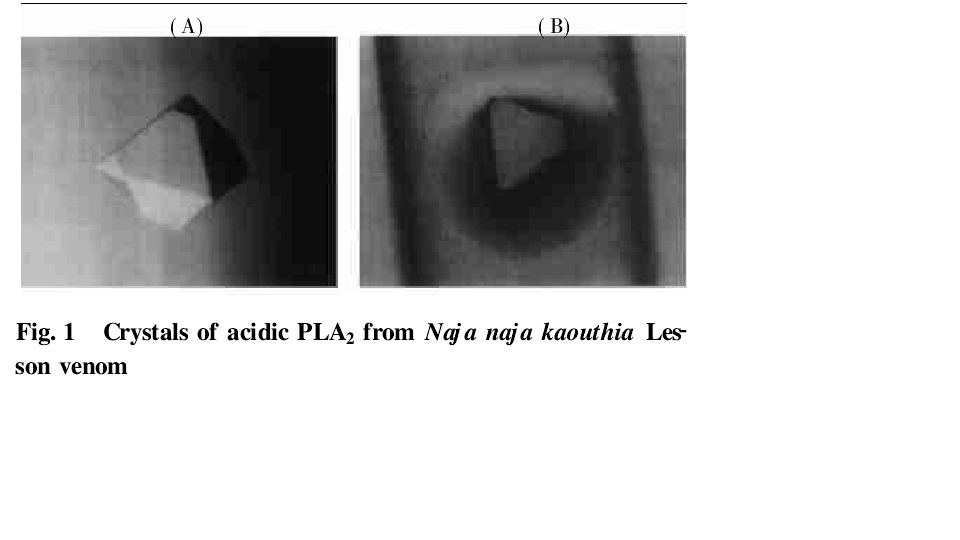 廣西眼鏡蛇毒磷脂酶晶體電鏡照片
廣西眼鏡蛇毒磷脂酶晶體電鏡照片
 廣西眼鏡蛇毒磷脂酶晶體電鏡照片
廣西眼鏡蛇毒磷脂酶晶體電鏡照片構象
蛇毒PLA2這一類小分子蛋白的構效關係是很微妙的。從廣西眼鏡蛇中分離得到的一種PLA2經X線結晶確定有2種晶體結構,該酶以三聚體形式存在。此三聚體有極廣的催化活性,可允許底物進入並與催化位點相互作用。同時三聚體的形式還可提高它在毒液中的溶解度,在無陽離子的條件下,其Ca2+結合環可根據周圍環境的變化以不同形態存在。台灣眼鏡蛇PLA2中有兩個主要的同工酶PLA2-Ⅰ和PLA2-Ⅱ,但PLA2-Ⅰ的酶活性要高於PLA2-Ⅱ,這可能是因為PLA2-Ⅱ有兩個胺基酸與PLA2-Ⅰ不同,另外兩個高保留殘基His-47和Asp-73對PLA2的催化活性也發揮著必不可少的作用。計算機圖譜研究證實,天然PLA2同工酶及其位點定向突變的不同導致了它們生物活性的差異。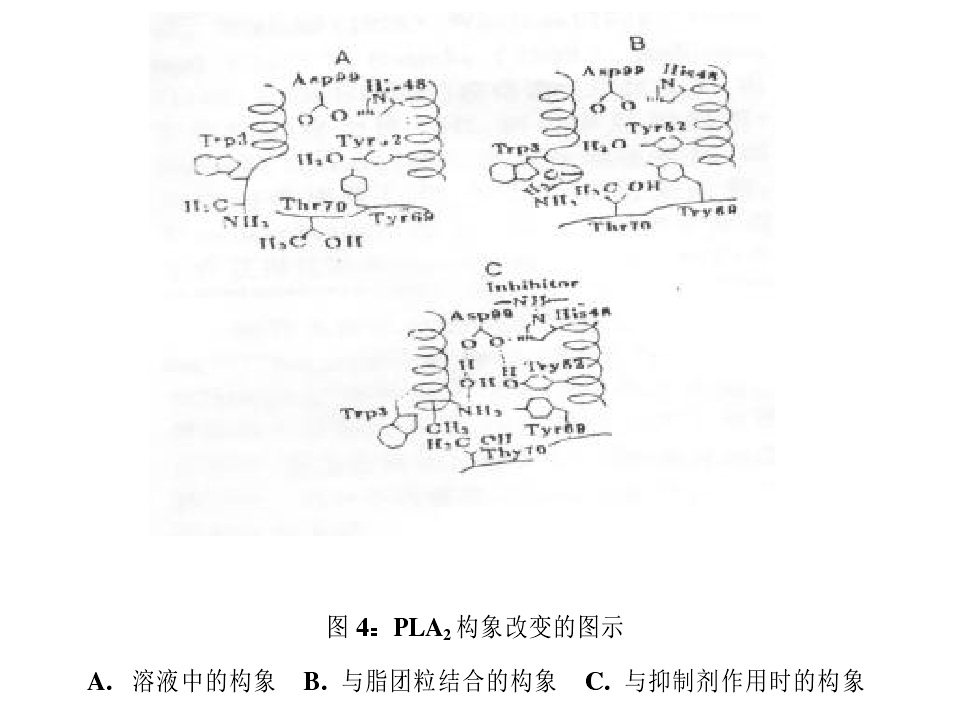 眼鏡蛇毒磷脂酶構象
眼鏡蛇毒磷脂酶構象
 眼鏡蛇毒磷脂酶構象
眼鏡蛇毒磷脂酶構象空間結構
眼鏡蛇毒磷脂酶A2由兩條反平行的螺旋(helicex 2and3)形成一個腳手架區域,固定了Ca2+結合環。N-端螺旋(helix 1)通過側鏈基團與蛋白質整體的作用而使位置得到固定。高度保守的殘基集中在這兩個螺旋中。並通過Asp49 (位於helix 2)與Ca2+結合環起作用。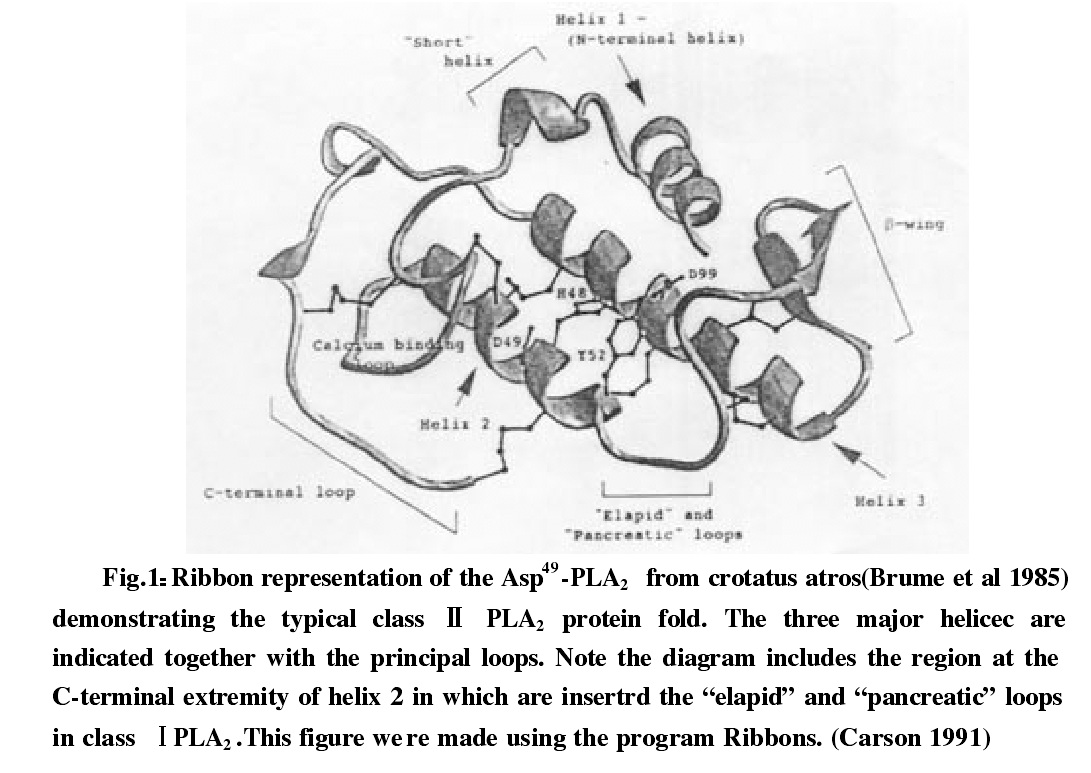 眼鏡蛇毒磷脂酶空間結構
眼鏡蛇毒磷脂酶空間結構
 眼鏡蛇毒磷脂酶空間結構
眼鏡蛇毒磷脂酶空間結構眼鏡蛇毒磷脂酶空間結構圖冊參考資料。
在Lys49-PLA2中Lys49取代了Ca2+結合環上的Ca2+結合的部位。從而喪失了Ca2+結合的能力,而失去了對人工底物的催化能力。Macin,et,al做的體外實驗表明在多聚陽離子存在下,多種Lys49-PLA2都有PLA2活力,這表明Lys49取代了Asp49,仍具有脂結合能力及水解磷脂的能力。對PLA2四級結構的研究表明,很多PLA2在溶液中以多聚體形式存在,動力學研究表明PLA2的酶活性在形成二聚體或更多聚合體後才能夠得到充分發揮,在Asp49-PLA2上,酶的活性部位被蛋白質主體所掩蓋,而Lys-PLA2的活性部位卻暴露在溶液之中,這或許可能解釋為什麼Lys-PLA2不能催化人工底物,從圖中還可看到PLA2的活性中心完全包在二聚體內部,從而阻止了非特異底物同酶分子的結合,三個二聚體之間存在著大量的疏水相互作用,其作用部位正是界面激活部位,這種聚集方式很可能代表了PLA2同膜的結合方式。
毒理學
Volwerk等發現磷脂酶A2的H48被BPB(p-bromo-phenacyl-bromide)共價修飾後喪失全部酶活力,Verheij等也證明H48的甲基化導致酶活力的喪失,據此,他們認為H48是磷脂酶A2的催化殘基,晶體結構表明,與H48共價連線pBPB恰好位於疏水通道內,使得底物分子無法到達催化殘基H48,Kuipers等用定點突變的方法研究了磷脂酶A2中完全保守的D99,Y52,和Y73對於酶活力的影響,Thunnissen等SekhArudu等分別測定了豬胰Y52F,Y73F突變體和牛胰磷脂酶A2的Y52F/Y73F雙突變體的晶體結構,探討Y52,Y73對磷脂酶A2功能的作用。P.B.Sigler研究組在1990年提出了關於PLA2催化機理的假說,從催化機理來看,PLA2與絲氨酸蛋白酶有相似之處,後者有Ser,-His,-Asp構成催化三聯體,PLA2的不同之處在於有一個水分子代替了絲氨酸蛋白酶的Ser羥基而作為親核試劑,磷脂底物進入疏水通道後,它的兩條疏水尾恰好與通道壁形成穩定的疏水相互作用,其頭部則到達催化中心,底物的,Sn-2羰基氧原子及Sn-3-磷酸基團的pro-S氧原子將取代兩個配位水分子,W5和W12同鈣離子形成配位,H48的側鏈咪唑環作為一個酸鹼催化劑,它的N1從催化水分子W6,獲得一個質子,水分子的羥基則對底物Sn-2位酯鍵的碳原子進行親核攻擊,使得底物形成帶負電的四面體過度態,質子化的H48被它與D99,Y52,Y73之間的氫鍵網路所穩定而處於過度態的底物中原來的酯鍵羰基,O原子則被位於鈣離子結合環內的鈣離子以及與G30的肽鍵形氫鍵所穩定,同時鈣離子還與底物的磷酸基團的O原子形成配位鍵,最後H48將它從水分子W6獲得的質子傳遞,酯鍵斷裂,生成溶血磷脂和脂肪酸。
Peters通過NMR研究PLA2在有或無競爭性抑制劑存在下PLA2與團粒界面結合時的構象變化,認為PLA2的激活分為兩步,首先與團粒界面結合發生構象改變,而由很多氫鍵形成的催化活性構象,必須在PLA2與底物或競爭性抑制劑在水-脂界面結合時才能形成,溶液中的天然酶N-末端螺旋尚未形成,Thr-70與其它分子沒有作用,但Tyr-69,與Tyr-52有輕微作用,當PLA2與脂團粒結合時,N-末端重新排列Tyr-3,和Ala-1的側鏈與脂團粒有作用,Tyr-69與Thr-70向內移動氫鍵網路形成不完全,最後,當PLA2與抑制劑作用時,N-末端螺旋形成,氫鍵網路也形成,主要氫鍵的形成固定了,N-末端和活性位點殘基,這些結果都證明了界面催化機制。
突觸前神經毒素可能與PLA2上的80-110位殘基之間的疏水性區域有關,沒有突觸前神經毒性,PLA2就沒有這種疏水區域,對電荷密度分布的研究發現,有肌肉毒素活性的PLA2疏水的E螺旋中含有特異的氧離子區域,而在沒有肌肉毒性的PLA2中卻沒有這類結構。對抗凝的作用位點進行研究發現,與抗凝活性有關的殘基區域,在這一端區域裡,具有強抗凝活性的,PLA2的賴氨酸被中性胺基酸或者酸性胺基酸所代替,而在沒有抗凝活性的,PLA2中則沒有這一現象。所有上述的作用位點都在PLA2分子的表面,從而非常容易與細胞表面的靶位點相結合。同時也說明沒有這些作用位點的PLA2分子就不會引起一些藥理活性現象。除了靶位點與作用位點,人們傾向於認為是蛇毒PLA2的這些藥理活性及對特定膜磷脂的選擇性可能與同它們結合的高親和力專一受體有關,PLA2與特異靶組織上的高親和力受體結合,由受體介導產生這許多藥理作用。
眼鏡蛇毒磷脂酶作用靶標示意圖冊參考資料。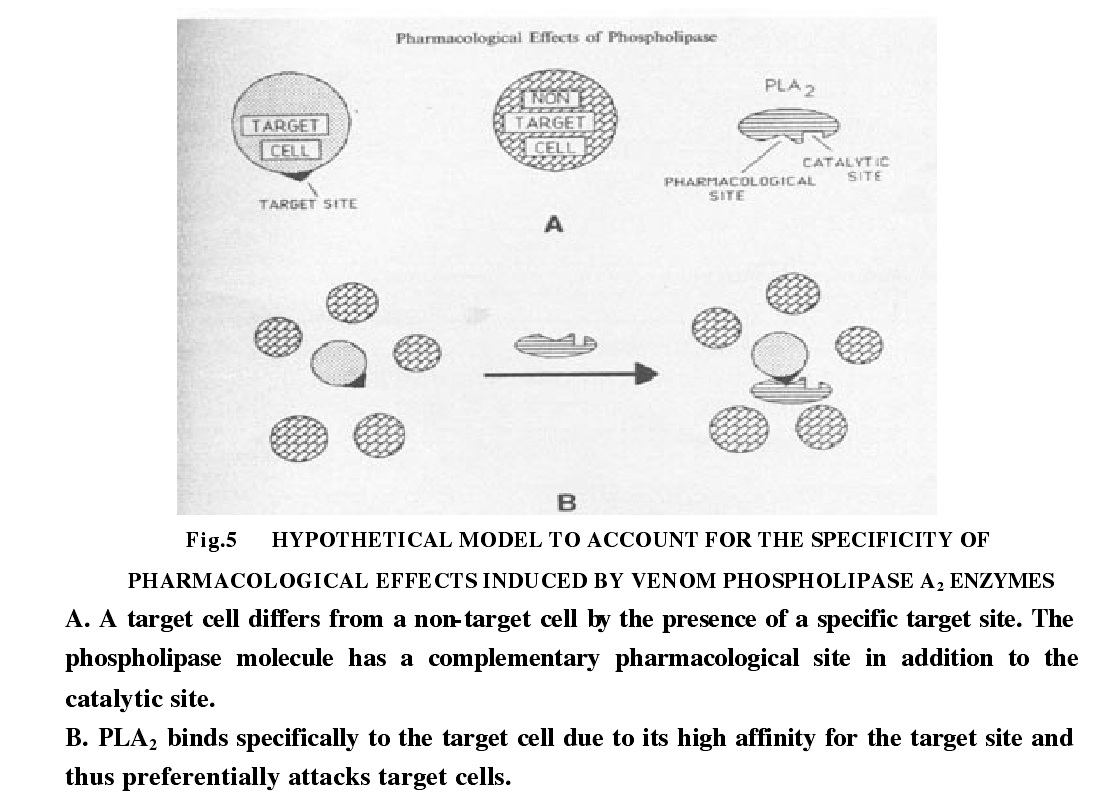 眼鏡蛇毒磷脂酶作用靶標示意圖
眼鏡蛇毒磷脂酶作用靶標示意圖
 眼鏡蛇毒磷脂酶作用靶標示意圖
眼鏡蛇毒磷脂酶作用靶標示意圖PLA2受體有二種,最早在大腦中發現的N-type神經類PLA2受體,對一些毒性的PLA2具有高的親和力,包括OS2。N-typePLA2受體是由大約40-50個單位的多肽組成的,分子量,85kD,在PLA2與受體結合的時候,需要鈣離子,但是實驗證明,OS2的酶活性和鈣離子濃度的關係與受體結合活性和鈣離子濃度的關係是不一致。OS2的磷脂酶活性不直接參與OS2與神經膜的結合。
毒物作用模式
眼鏡蛇毒PLA2除了具有催化作用之外,還具有多種藥理活性,如神經毒性、心臟毒性、肌肉毒性以及誘導或抑制血小板聚集、溶血或抗凝。一般來說,一種PLA2能夠引起兩種或多種不同的藥理學活性,但尚未發現一種PLA2具有以上所有的藥理學性質。
對血液系統的作用
眼鏡蛇毒PLA2對血液系統有明顯的抗凝、纖溶、出血、溶血作用,其中對血小板聚集的影響報導較多。不同種類的眼鏡蛇毒PLA2對血小板聚集功能的作用也不同,如台灣眼鏡蛇毒PLA2能誘導血小板聚集,而印度眼鏡蛇毒中所含的酸性PLA2則是抑制血小板聚集。廣東產眼鏡王蛇毒酸性PLA2-Ⅰ進一步分離純化得到的ⅠB型PLA2也已被證實對ADP、花生四烯酸和凝血酶誘導的兔血小板聚集均有抑制作用,並具有劑量依賴關係,提示PLA2對血小板聚集的多條途徑均有抑制作用,可能是作用於血小板聚集的某一最後通道。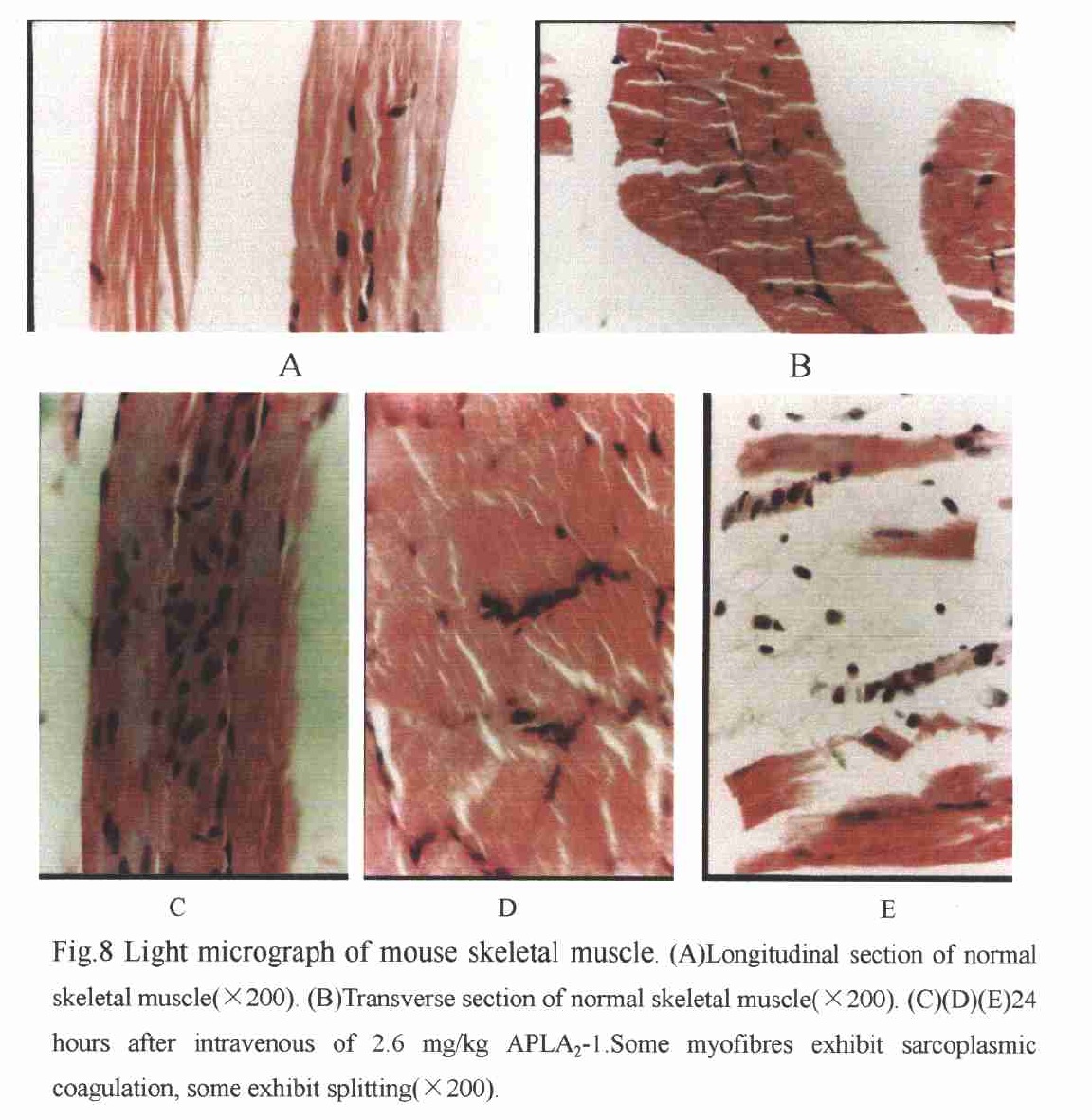 注射毒素後小鼠肌肉切片
注射毒素後小鼠肌肉切片
 注射毒素後小鼠肌肉切片
注射毒素後小鼠肌肉切片蛇毒PLA2的溶血活性作用主要被認為是由於對紅細胞膜磷脂的水解釋放溶血磷脂所引起,因此其溶血作用是間接的結果。劉小龍等認為PLA2的溶血活性不僅與酶水解活性有關,與蛋白質的等電點和C 端的陽性胺基酸殘基也有很大的關係,但也有研究發現Lys49PLA2同源物無酶水解活性,但有溶血活性。
既有誘導血小板聚集活性又有抑制血小板聚集活性的眼鏡蛇毒PLA2從V.Russellii和Apis,mellifera蛇毒中均分離純化到。這種對血小板聚集既有誘導又有抑制雙重活性的PLA2在低濃度的時候誘導血小板聚集,在高濃度的時候抑制血小板聚集。蛇毒PLA2的溶血作用主要被認為是由於對紅細胞膜磷脂的水解釋放溶血磷脂所引起,因此其溶血作用是間接的結果,由於PLA2結構上的差異,因而對紅細胞膜磷脂的水解也各有其特徵,江浙蝮蛇蛇毒中PLA2的研究表明,就水解卵磷脂的酶活力而言,鹼性PLA2的酶活力最低,但具有強烈的溶血活性,酸性PLA2的酶活力最高,卻幾乎無溶血活力,而中性PLA2介乎兩者之間抗凝血作用。
神經毒性
被眼鏡蛇咬傷的病人死亡的一個主要原因就是蛇毒中存在一個或多個“3-finger”神經毒素,引起了呼吸麻痹。但黎明濤等在研究中華眼鏡蛇蛇毒補體依賴的神經元毒性作用中卻意外發現,由蛇毒中分離得到的分子量為14 ku,以二聚體形態存在的sPLA2可明顯減少低鉀誘導的小腦顆粒神經元細胞的凋亡,有效地保護神經元,且其抗神經元凋亡作用不依賴其本身的PLA2活性,可能通過受體介導。另外選取其它6種來自不同種屬、亞群的sPLA2,發現其中分別來自莫三比克眼鏡蛇毒的sPLA2-ⅠA、西部菱斑響尾蛇毒的sPLA2-Ⅱ和蜂毒的sPLA2-Ⅲ也有相同的作用。
肌肉骨骼毒性
局部和系統骨骼肌壞死是被蛇咬傷後的一個常見症狀,而PLA2則是這些毒素中重要的肌毒性成分。PLA2能夠對骨骼肌造成損害,並使得肌肉變性。這種損害是通過非常專一的途徑,能在十五分鐘內引起骨骼肌快速壞死,並通過破壞漿膜,引起肌纖維收縮,然後溶解細胞成分。 注射毒素後小鼠骨骼肌電鏡
注射毒素後小鼠骨骼肌電鏡
 注射毒素後小鼠骨骼肌電鏡
注射毒素後小鼠骨骼肌電鏡通過骨骼肌和心肌的電鏡、光鏡觀察及血清肌酶檢測,證實了廣西眼鏡蛇毒PLA2-Ⅰ具有肌毒性,且骨骼肌比心肌對PLA2-Ⅰ更為敏感,與別的肌毒性PLA2相比,PLA2-Ⅰ的毒力顯得較為緩慢溫和。研究表明,肌毒性PLA2可與血漿膜上的受體(脂質或蛋白質)相結合,通過酶依賴或非酶依賴途徑破壞血漿膜的整體性,顯著地促進Ca2+內流,從而誘發一系列複雜的與高收縮相關的惡化物質,激活鈣激活蛋白,使胞漿Ca2+、線粒體Ca2+過負荷,最終導致骨骼肌壞死。
心臟毒性
研究表明,注射酸性PLA2-Ⅰ腹壁靜脈插管給藥(2·6mg·kg-1)40min後,會逐漸引起麻醉大鼠ECG不正常,包括心率減慢、P-R間隔延長、QRS波群變寬、竇性心律不齊、室性早搏、室性自搏心律。而1 mg酸性PLA2-Ⅰ能引起離體Langendorff心臟的心率減慢、收縮力下降,最大收縮幅度為對照的(62±10)%,2 h後未見恢復。但關於其心臟毒性的確切機制尚不十分清楚。
致炎症作用
眼鏡蛇咬傷後,傷口常會出現炎症反應,而多形核細胞(PMN)是這一炎症反應的主要細胞組分。眼鏡蛇毒中的一種或多種PLA2可作為主要的化學誘導物增強PMN的動力和遷移力,引起PMN在傷口處聚集,並伴有膠原受體CD49b的表達增加,而蛇毒PLA2的抑制劑馬兜鈴酸可減小PMN遷移力的增強。報導顯示,眼鏡蛇毒PLA2首先引起PMN的非酶激活,從而激活胞漿PMNPLA2,並釋放花生四烯酸代謝物參與誘導PMN的脫顆粒和活性的增加,再與激活的PMN表面的陰性磷脂相互作用引起內吞,最終導致PMN在蛇咬傷口處積聚。馬兜鈴酸只能部分地削弱PMN的聚集作用,但特殊的胞漿PLA2抑制劑MAFP則能完全抑制PMN的聚集。
其他作用
一定量的眼鏡蛇毒PLA2能使人紅細胞影膜磷脂和用去污劑處理的混合微粒磷脂水解,但對新鮮完整的紅細胞磷脂卻無作用。印度眼鏡蛇毒PLA2可使鼠肝細胞膜的通透性增加,當磷脂醯乙醇胺約有1/4-1/3水解時,細胞內的穀草轉氨酶即被釋出,水解達1/2-2/3時,細胞外觀仍無改變。眼鏡蛇毒PLA2還能抑制線粒體琥珀酸氧化酶和琥珀酸細胞色素C還原酶的活性,從而抑制細胞色素C的電子傳遞,最終影響呼吸鏈的功能,且這一抑制作用與PLA2的量呈劑量依賴關係。眼鏡蛇毒中鹼性最強的PLA2也可作用於鼠腦膜中兩種性質不同的[Na+,K+]-ATP酶,發揮特異性抑制作用。
醫學作用
眼鏡蛇毒對肝癌、胃癌、鼻咽癌、卵巢癌、宮頸癌以及淋巴瘤均有明顯的抑瘤效果,對小鼠移植性瘤如S180也有一定的抑制作用,其抗癌的機制可能與改變細胞膜的結構和功能,調整自由基水平,增強體內的免疫應答有關。關於眼鏡蛇毒抗癌作用的研究主要為粗毒的研究,關於蛇毒成分中的某一單體如其主要的活性成分眼鏡蛇毒PLA2的研究就較少。有人發現眼鏡蛇毒PLA2ⅠB在溶血磷脂(LPA)的快速形成和由LPA誘導的LPA形成這兩個途徑中均有重要作用,眼鏡蛇毒PLA2ⅡA則僅對LPA誘導的LPA形成有影響。LPA可促進卵巢癌細胞增殖,降低卵巢癌常用藥順鉑的敏感性,減少凋亡和蛋白酶生成以及新血管生成中介物的產生,因此,眼鏡蛇毒PLA2是一種潛力較大的抗癌製劑。
