基本介紹
- 中文名:分子空間構型
- 外文名:Molecular Geometries
- 簡稱:分子構型
- 實質:分子中的原子在空間中的幾何分布
- 預測理論:價層電子對理論
- 決定因素:分子內化學鍵的鍵長和鍵角數據
雜化軌道與分子構型
sp雜化
sp2雜化
sp3雜化
價層電子對互斥理論
預測分子空間構型步驟
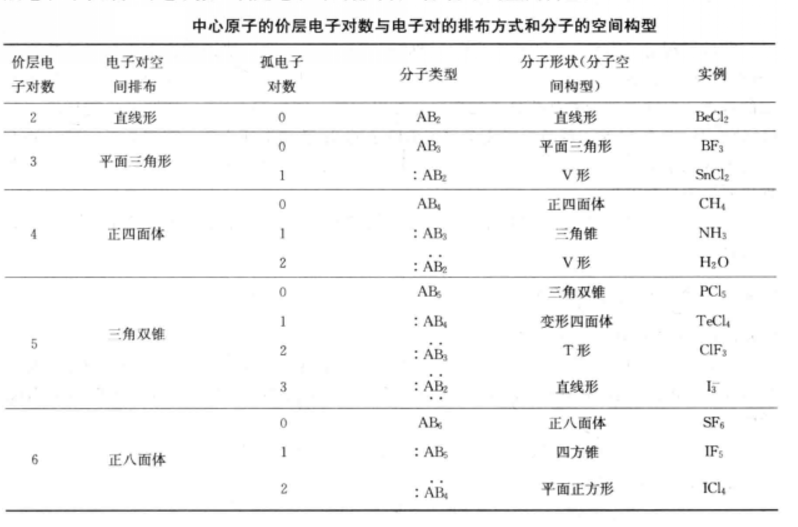

分子的空間構型是指分子中各種基團或原子在空間分布的幾何形狀。分子中的原子不是雜亂無章地堆積在一起,而是按照一定規律結合的整體,使分子在空間呈現出一定的幾何...
共價化合物分子中各原子在空間相對排列關係,稱為分子的空間構型或幾何構型。共價鍵具有方向性,在相同成分的分子中,若原子的排列次序和排列方式不同,可形成不同的...
分子結構涉及原子在空間中的位置,與鍵結的化學鍵種類有關,包括鍵長、鍵角以及相鄰三個鍵之間的二面角。原子在分子中的成鍵情形與空間排列。分子結構對物質的物理...
構型(configuration)指的是一個有機分子中各個原子特有的固定的空間排列。比如:正·異·Z·E·R·S這種排列不經過共價鍵的斷裂和重新形成是不會改變的。構型的...
分子的構型,分子中各種基團在空間的分布。...... 分子的構型,分子中各種基團在空間的分布。目錄 1 正文 分子的構型正文 編輯 各種基團按不同的方位相互連線,可形...
分子是由組成的原子按照一定的鍵合順序和空間排列而結合在一起的整體,這種鍵合順序和空間排列關係稱為分子結構。由於分子內原子間的相互作用,分子的物理和化學性質...
絕對構型表示手性分子中各個基團在空間的真實排列關係,即絕對的空間關係。一個化合物,當其結構式按規定所表達的立體結構,與該化合物分子的真實的立體結構一致時,...
手性分子是指與其鏡像不相同不能互相重合的具有一定構型或構象的分子。手性一詞來源於希臘語“手”(Cheiro),由Cahn等提出用“手性”表達旋光性分子和其鏡影不能相...
每個單鍵圍繞其相鄰的單鍵做不同程度的內旋轉,分子內原子在空間的排布方式隨之...(constitution)是指分子中原子相互聯結的方式和次序,過去長期以來稱為分子結構(...
換句話說,化學鍵確定了鏈節中原子的空間排布方式。由化學鍵固定的原子空間排布方式稱作構型(configuration)。構型由聚合反應所決定,在高分子物理中我們只關心構型的不...
按照量子力學的軌道近似法,原子、離子或分子中的每一個電子被認為各處於某自旋和軌道的狀態。體系中全體電子所處的自旋和軌道的總體,構成了整個體系的電子構型。...
八面體形分子構型指的是一個分子中,中心原子上連有六個基團或配體而形成八面體的分子構型。...
為單原子分子,雙原子分子及多原子分子;按照電性結構可分為有極分子和無極分子...反映分子中原子在空間的排列次序與分布稱為分子的構型。分子中原子間的化學鍵長...
北京大學科學家在世界上首次拍到水分子的內部結構,並揭示了單個水分子和四分子水團簇的空間姿態。這一成果發表在《自然-材料》雜誌上。...
赤型構型為描述一些開鏈含2個手性中心化合物的構型,由赤蘚糖(erythrose)派生...2、對映體是指具有相同分子式的化合物中,由於原子在空間配置不同而引起的同分...
化學中的空間結構是指分子中各個原子在空間位置分布,即分子的立體構型。 比如:甲烷分子,在空間是個四面體結構, 乙烯的分子結構是個平面對稱具有對稱中心的構型; 又...
一級結構,也叫化學結構,是分子中胺基酸的排列順序。首尾相連的胺基酸通過氨基與羧基的縮合形成鏈狀結構,稱為肽鏈。肽鏈主鏈原子的局部空間排列為二級結構。二級結構在...
3 分子簡介 4 高分子科學的興起 5 天然高分子的化學轉化 6 連結結構 7 ...特別應當提起的是,在航天技術中,火箭或人造衛星殼體從外部空間回到大氣層時,速度...
若已知鍵角(或空間結構),可進行受力分析,合力為0者為非極性分子.如:CO2,C2H4,BF3非極性分子同種原子組成的雙原子分子都是非極性分子。...
晶體以其內部原子、離子、分子在空間作三維周期性的規則排列為其最基本的結構特徵。任一晶體總可找到一套與三維周期性對應的基向量及與之相應的晶胞,因此可以將...
雜化軌道理論(Hybrid Orbital Theory)是1931年由鮑林(Pauling L)等人在價鍵理論的基礎上提出,它實質上仍屬於現代價鍵理論,但是它在成鍵能力、分子的空間構型等方面...
價鍵理論成功地解釋了共價鍵的本質和特性,可以說明一些簡單分子的內部結構,但在闡明多原子分子的幾何構型時遇到困難。為了解釋多原子分子的幾何構型,鮑林(L.Pauling)...
有關理論認為N2O與CO2分子具有相似的結構(包括電子式),則其空間構型是直線型,N2O為極性分子。 現在主要用於表演,也可以用來做賽車加速器中的助燃劑。...
識別與判斷同分異構體的關鍵在於找出分子結構的對稱性,在觀察分子結構時還要注意分子的空間構型。例⒍下列事實能夠證明甲烷分子是正四面體結構,而不是平面正方形結構...
