簡介 在
偏振光 發現之後,人們很快認識到某些物質能使偏振光的偏振面發生偏轉,產生
旋光現象 。1848年法國巴黎師範大學年輕的化學家Pastenr細心研究了酒石酸鈉銨的晶體及水溶液的旋光現象,從而得出物質的旋光性與分子內部結構有關,提出了
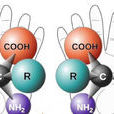
對映異構體 的概念。人們在研究對映異構體時,由左旋和右旋兩種對映異構體的分子中,原子在空間的排列是不重合的實物和鏡象關係,這與左手和右手互為不能重合的實物和鏡象關係類似,從而引入了手性及手性分子的概念。所謂手性,是指物體和它的鏡象不能重合的特徵。所謂手性分子,顧名思義為具有手性的分子。即構型與其鏡象不能重合的分子。手性分子都存在對映異構現象,一對對映異構體在性質上的表現為:在手性條件下具有手性。例如,在偏振光這一手性條件下,一對對映異構體的物理常數比旋光度大小相等而方向相反。又例如,某一化學反應,如果在手性試劑、手性催化劑、手性溶劑等手性條件下進行,則可能生成或主要生成單一的對映異構體。更重要的是,一對對映異構體在生理活性上往往是各自不同的。
手性分子的普遍性和重要性:
手性是宇宙間的普遍特徵,體現在生命的產生和演變過程中。例如,自然界存在的糖以及核酸、澱粉、纖維素中的糖單元,都為D—構型;地球上的一切生物大分子的基元材料α—胺基酸,絕大多數為L—構型;蛋白質和DNA的螺旋構象是右旋的;而且人們還發現,海螺的螺紋和纏繞植物也都是右旋的。面對這充滿手性的自然界,人們不斷發現,生物體記憶體在著手性環境。作用於生物體內的藥物及農藥,其藥效作用多與它們和體內靶分子間的手性匹配和手性相關。因此,手性藥物和手性農藥的研究就尤為重要。在用於治療的藥物中,有許多是手性藥物。而手性藥物的不同對映異構體,在生理過程中會顯示出不同的藥效。尤其是當手性藥物的一種對映異構體對治療有效,而另一種對映異構體表現為有害性質時,情況更為嚴重。
手性分子 20世紀60年代的“
反應停 (Thalidomide)悲劇”就是一個突出的例子。之後的研究發現,消旋體“反應停”中,只有它的(R)-異構體有鎮靜作用,而它的(S)-異構體則是具有致畸作用的.慘痛的教訓使人們認識到,手性藥物必須對它的兩個異構體進行分別考察,慎重對待.一些藥物的另一對映異構體,表現有不良作用的例子還很多。
手性農藥的重要性和藥物情況類似,也往往是一種農藥的另一對映異構體對農作物有著有用的或有害的作用。例如,芳香基丙酸類除草劑fluazifop-butyl,只有(R)—異構體是有效的。又如
殺蟲劑 asana,是含兩個不同手性中心的手性分子,存在四個構型異構體,但真正有強力殺蟲作用的只有一種異構體,其餘三種不但沒有殺蟲作用,而且對植物有毒。
殺菌劑 paclobutrazol,也是含有兩個不同手性中心的手性分子,有四個構型異構體,組成兩對對映異構體。但其中一對的作用相反,(R,R)—異構體具有高殺菌、低生長控制作用;而(S,S)—異構體則為低殺菌、高生長控制作用。另外,除蟲菊酯中不同異構體生物活性差異的例子更多。
手性分子識別 手性識別與分離的技術發展迅速,其中
色譜法 、感測器法和
光譜法 等具有適用性好、套用範圍廣、靈敏度高、檢測速度快等優點,在分離識別和純化手性化合物中受到研究者的極大關注。
色譜法 色譜法可滿足各種條件下對映體拆分和測定的要求,能夠快速對手性樣品進行定性、定量分析和製備拆分。目前,高效液相色譜、氣相色譜、超臨界流體色譜、模擬移動床色譜和毛細管電泳等在手性研究中得 到 了 廣 泛 應 用。其 中,高 效 液 相 色 譜 法(HPLC) 進行手性藥物對映體的光學拆分已成為藥學研究中的一大熱點,開發一些新型、具有不對稱中心的手性固定相成為發展手性色譜技術的前沿領域之一。在手性固定相材料中,手性選擇劑和手性分子間形成非對映異構體絡合物,但由於不同對映體分子間存在空間結構的差異,直接影響兩者的結合和絡合物的穩定性。根據這些差異有望實現對手性底物的拆分。以環糊精衍生物、多糖衍生物和蛋白質等為手性選擇劑的手性固定相材料備受研究者的關注,它們對許多手性藥物對映體表現出良好的分離性能,已有許多填充手性固定相的色譜柱實現商品化,廣泛套用在製藥工業、化學品和食品等行業中。
手性感測器識別法 手性感測器識別法具有簡單快捷、高效靈敏和選擇性高的特點。電化學感測器主要通過主體選擇性鍵合客體分子引起感測器的電信號變化而實現手性識別;螢光感測器基於對映體分子和手性選擇劑形成締合物的螢光差異來實現識別。在壓電感測器中,手性選擇膜鍍在石英晶體上,當手性分子與手性膜發生作用時,會引起石英晶體的質量和振動頻率改變,故稱為石英晶體微天平(Quartz CrystalMicrobalance,QCM)QCM技術始於20世紀60年代初期,因具有靈敏度高、檢測限低( 達到納克級)、快速、容易實現線上分析檢測的特點,在手性化合物的識別和檢測方面得到很好的套用。
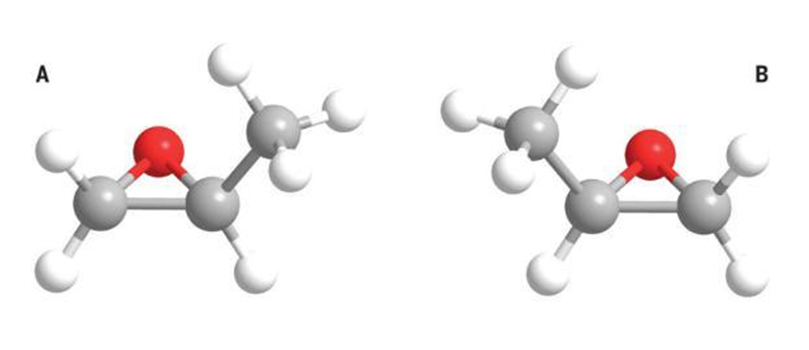
光譜法 命名 手性分 子R/S構 型 的 命 名 方 法,由Cahn - In - gold -Prelong提出,故簡稱CIP法。因該法較D/L法具有顯著的優點,故一經刊出,便很快得到廣泛採用,並於1970年由IUPAC正式推薦使用。
用CIP法命名手性分子的R/S構型時,一般分兩步進行,首先定出手性元素———手性中心,手性軸和手性面等———上所連四個基團的大小順序,然後通過分子模型 ( 或想像) 所建立起來的三度空間的分子形象,根據CIP法的規則判定為R或S構型。
雖說用模型組建起分子後加以命名是件容易的事,但模型不可能常在手邊; 若運用想像,又很容易出錯,特別是對結構較複雜的化合物更是如此。近些年來,為了解決上述不便,尋找一種既簡便快速又準確無誤且不用分子模型的方法,對各種用二度空間的分子形象如費歇投影式、楔形式、扭曼投影式和透視式等加以R/S命名,種種方法相繼問世。這些方法,雖說各有大小不同程度的方便之處,但大都存在著不夠簡便或局限性大的缺點,因而適用範圍狹窄,而不能成為一種通用的方法。但統觀這些已見諸文獻的所有方法,筆者認為,手模型法較好。該法主要是把手掌當作手性元素 (chiral element,即手性中心、手性軸或手性面等) ,把拇指、食指、中指指尖和手腕分別代表手性元素上所連四個不同的原子或基團,將三個手指頭握成一定的形態,與手腕一起構成近乎正四面體模型,然後按CIP法命名。
手模型法 用手作模型來標定R/S構型,首先由Thoman提出,後經Garrett、Beauchamp、李光熹和Maltern等加以改進。但Garrett規定把最小基團 (forth priority group) 記在手腕上、最大基團 (first priority group) 記在拇指上;Beauchamp規定把最小基團記在手腕上;Maltern把最大基團記在中指上,次大基團 (second priority group) 記在食指上、再次大基團 (thirdpriority group) 記在拇指上; 李光熹則規定,最小基團在橫向鍵時,用手腕和食指標記橫向基團、最小基團在豎向鍵時,則以手腕和食指標記豎向基團。以上種種規定,僅對某些構型式標定R/S型有點方便,但總的說來,它使得幾乎和真模型一樣好用的手模型變得僵化,使用起來有很大的局限性,只能用於部分手性分子構型式的命名,尤其在某些化合物構型的命名時,還要經過改寫結構式等手續,存在諸多不便。
手性技術的發展 手性技術是建立在科學基礎之上的。因此,手性技術的發展首先應該是有關基礎的發展。這些基礎首先是有機立體化學理論的建立,其次是消旋體拆分方法的完善,第三是手性合成的創新,另外還有其他一些相關的研究。
消旋體的拆分,是手性技術的一個重要方面。在由非手性物質合成手性物質時,往往得到的是由一對等量對映異構體組成的消旋體。或者在由含一個手性碳化合物轉變成為另一種含一個手性碳化合物時,由於反應過程中經過碳正離子、游離基等活性中間體步驟,結果都會發生完全或部分的消旋化。如果要得到其中一種具有生理活性的對映異構體,就必須通過消旋體的拆分。消旋體拆分的方法很多,經典的主要有:晶體的機械拆分法、誘導結晶拆分法、表面優先吸附法、生物化學法以及化學拆分法。這些方法的最大缺陷是有一半無用的對映異構體可能浪費掉,對環境保護及對經濟效益都是不利的。如果能進一步完善,則是十分有意的。
手性技術的另一個重要方面就是手性合成。所謂手性合成,就是通過化學反應,由非手性化合物合成得到手性化合物。如果反應在合適的手性條件下進行,則可生成不等量甚至單一的對映異構體。
手性合成是手性技術中非常活躍的領域,特別是手性催化反應.Knowles、Sharpless和Noyori三位諾貝爾獎得主,經過十餘年不斷研究,發現了一系列手性催化氫化反應和手性催化氧化反應。他們用過渡金屬催化的氫化和氧化反應,不但使手性合成進入了新的發展階段,而且已被套用於工業化的生產。
用過渡金屬催化的手性氫化,是Knowles最早成功和最廣泛研究的手性合成反應,它的成功帶動了多種學科的發展。至今已有1000餘個手性膦配體合成得到,而且人們對於手性氫化的機理、產生手性誘導的因素以及過渡金屬的作用等諸方面都進行了深入的研究。用過渡金屬催化的手性氧化,是Sharpless歷經十年努力才實現的催化性反應,成為了目前廣泛套用的手性合成反應之一。
生命與手性 作為生命的基本結構單元,
胺基酸 也有手性之分。也就是說,生命最基本的東西也有左右之分。
驚人的發現---組成地球生命體的幾乎都是左旋胺基酸,而沒有右旋胺基酸
我們已經發現的胺基酸有20多個種類,除了最簡單的
甘氨酸 以外,其它胺基酸都有另一種手性對映體!那么,是不是所有的胺基酸都是手性的呢?答案是肯定的,檢驗手性的最好方法就是,讓一束
偏振光 通過它,使偏振光發生左旋的是
左旋胺基酸 ,反之則是右旋胺基酸。通過這種方法的檢驗,人們發現了一個令人震驚的事實,那就是除了少數動物或昆蟲的特定器官內含有少量的右旋胺基酸之外,組成地球生命體的幾乎都是左旋胺基酸,而沒有右旋胺基酸!
右旋分子是人體生命的剋星!
因為人是由左旋胺基酸組成的生命體,它不能很好地代謝右旋分子,所以食用含有右旋分子的藥物就會成為負擔,甚至造成對生命體的損害。
在手性藥物未被人們認識以前,歐洲一些醫生曾給孕婦服用沒有經過拆分的消旋體藥物作為鎮痛藥或止咳藥,很多孕婦服用後,生出了無頭或缺腿的先天畸形兒,有的胎兒沒有胳膊,手長在肩膀上,模樣非常恐怖。僅僅4年時間,世界範圍內誕生了1.2萬多名畸形的“海豹嬰兒”。這就是被稱為“
反應停 ”的慘劇。後來經過研究發現,反應停的R體有鎮靜作用,但是S-
對映體 對胚胎有很強的致畸作用。
正是有了60年代的這個教訓,所以現在的藥物在研製成功後,都要經過嚴格的生物活性和毒性試驗,以避免其中所含的另一種手性分子對人體的危害。
在化學合成中,這兩種分子出現的比例是相等的,所以對於醫藥公司來說,他們每生產一公斤藥物,還要費盡周折,把另一半分離出來。如果無法為它們找到使用價值的話,它們就只能是廢物。在環境保護法規日益嚴厲的時代,這些廢品也不能被隨意處置,考慮到可能對公眾健康產生的危害,這些工業垃圾的處理也是一筆不小的開支。
因此,醫藥公司急切地尋找一種方法來解決這個問題,比如,他想要左旋分子,那么他就得想辦法把另一半右旋分子轉化成左旋分子。這個令人頭痛的問題已經得到了解決。科學家用一種叫做“不對稱催化合成”的方法解決了這一問題。這個方法可以廣泛地套用於製藥、香精和甜味劑等化學行業,給工業生產一下子帶來了巨大的好處,這項研究也獲得了2001年度的
諾貝爾化學獎 。毫無疑問,這個成果具有重要意義。
諾貝爾獎 21世紀第一頂諾貝爾化學獎的王冠,為美國科學家W. S.諾爾斯(Willian S. Knowles)、K.B.夏普雷斯(K.BarrySharpless)和日本
名古屋大學 教授
野依良治 (Ryoji Noyori)摘取。這三位2001年諾貝爾化學獎得主,在手性催化氫化反應和手性催化氧化反應方面進行了長期的探索,作出了卓越的貢獻。歷時100多年,人們對手性分子的認識在不斷地深入和完善,尤其是對於手性分子在自然界存在之普遍和對人類生活健康的重要作用,認識愈來愈深刻。特別從1980年以來的20餘年間,隨著生命科學研究和材料科學研究的有力推動,建立在手性分子研究基礎上的手性技術蓬勃興起,迅猛發展,成為了當代化學的熱點和前沿。
 手性分子
手性分子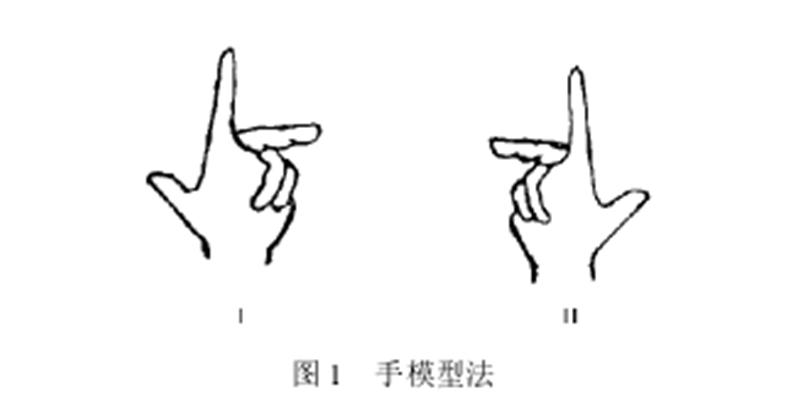 手模型法
手模型法