分子極性,即分子中正負電荷中心不重合,導致電荷的分布不均勻所產生的極性
基本介紹
- 中文名:分子極性
- 外文名:molecular polarity
- 分類:分子的極性、共價鍵的極性
定義
分子極性
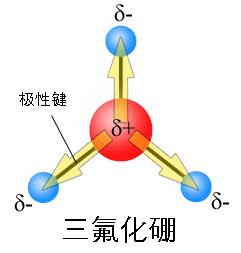
共價鍵的極性
鍵的極性程度可以用兩個原子電負性之差來衡量。差值在0.4到1.9之間的是典型的極性共價鍵。兩個原子完全相同(當然電負性也完全相同)時,差值為0,這時原子間成非極性鍵。相反地,如果差值超過了1.9,這兩個原子之間就不會形成共價鍵,而是離子鍵。
分子的極性
對性質的影響
推測
 圖片
圖片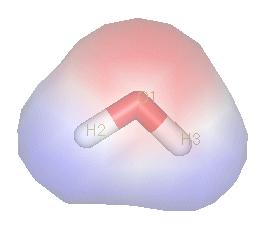 圖片
圖片
分子極性,即分子中正負電荷中心不重合,導致電荷的分布不均勻所產生的極性
 圖片
圖片 圖片
圖片分子中正負電荷中心不重合,從整個分子來看,電荷的分布是不均勻的,不對稱的,這樣的分子為極性分子,以極性鍵結合的雙原子分子一定為極性分子,極性鍵結合的多原子分子...
極性(polarity):物體在相反部位或方向表現出相反的固有性質或力量,對特定事物的方向或吸引力(如傾斜、感覺或思想);向特定方向的傾向或趨勢,對兩極或起電(如物體的...
分子極性,即分子中正負電荷中心不重合,導致電荷的分布不均勻所產生的極性...... 分子極性分子極性 在化學中,極性指一根共價鍵或一個共價分子中電荷分布的不均勻性。...
非極性分子是指偶極矩μ=0的分子,即原子間以共價鍵結合,分子里電荷分布均勻,正負電荷中心重合的分子。分子中各鍵全部為非極性鍵時,分子是非極性的(O3除外)。...
鍵的極性是由於成鍵原子的電負性不同而引起的。當成鍵原子的電負性相同或相近時,核間的電子云密集區域在兩核的中間位置附近,兩個原子核正電荷所形成的正電荷重心...
雙極性分子是指那些既有極性端又有非極性端的分子,也就是同時具有疏水性與親水性區的分子。例如磷脂,其烷基端是疏水端,磷酸端是親水端。 ...
無論是非極性分子還是極性分子,在外電場作用下,分子內的正、負電荷中心都會發生相對位移,產生誘導偶極,這一過程叫作分子極化。極性分子在無外電場作用時所具有的...
極性聚合物:狹義的極性聚合物一般指總偶極不為零的聚合物,廣義極性聚合物則指分子內具有較強極性鍵的聚合物。...
極性溶劑是指含有羥基或羰基等極性基團的溶劑,即溶劑分子為極性分子的溶劑,由於其分子內正負電荷重心不重合而導致分子產生極性。用於表征分子極性大小的物理量為偶極矩...
極性基團是指正負電荷中心不重合的基團,基團的極性可以用偶極矩來表征。距離為l,電量為±q的兩個點電荷構成一個電偶極子,用電偶極矩(簡稱偶極矩)μ=ql來表征,...
偶極矩是衡量分子極性大小的物理量。在物理學中,把大小相等符號相反彼此相距為d的兩個電荷(μ=q.d)組成的體糸稱之為偶極子,其電量與距離之積,就是偶極矩(μ...
分子結構,或稱分子立體結構、分子形狀、分子幾何,建立在光譜學數據之上,用以描述分子中原子的三維排列方式。分子結構在很大程度上影響了化學物質的反應性、極性、相...
分子是由帶正電荷的原子核和帶負電荷的電子組成的體系,由於電荷的相互作用,分子與分子間產生相互作用力。...
非極性基團是分子中的電子分布不產生顯著電偶極矩的有機部分。...... 非極性基團是分子中的電子分布不產生顯著電偶極矩的有機部分。中文名 非極性基團 外文名 n...
分子力(molecular force),又稱分子間作用力、范得瓦耳斯力,是指分子間的相互作用。當二分子相距較遠時,主要表現為吸引力,這種力主要來源於一個分子被另一個分子隨...
偶極(dipole)表示分子的極性。...... 固有偶極:極性分子中由於組成元素不同,其吸引電子的能力各有差異(元素周期律),這就使得分子中有電子偏移的現象,這樣就產生了...
