分子力(molecular force),又稱分子間作用力、范得瓦耳斯力,是指分子間的相互作用。當二分子相距較遠時,主要表現為吸引力,這種力主要來源於一個分子被另一個分子隨時間迅速變化的電偶極矩所極化而引起的相互作用;當二分子非常接近時,則排斥力成為主要的,這是由於各分子的外層電子云開始重疊而產生的排斥作用。
實驗表明,氣體很容易被壓縮;把各為50立方厘米的水和酒精混合,總體積小於100立方厘米;高溫下碳原子可滲透到鋼製表面。這些都說明都說明分子和原子之間仍保留一定距離。相隔一定距離的固體和液體分子仍能聚集在一起不分散,是因為存在分子間作用力。分子間作用力由吸引力和排斥力組成。吸引力對抗拉伸,排斥力對抗壓縮。
基本介紹
- 中文名:分子力
- 外文名:molecular force
- 別稱:分子間作用力
- 意義:是指分子間的相互作用
分子間的引力和斥力
分子間存在引力:
分子間存在斥力:
分子間引力和斥力的變化情況:
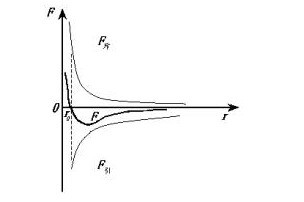 分子間作用力關係圖
分子間作用力關係圖