簡介
共聚焦顯微技術是在
螢光顯微分析技術的基礎上發展起來的,利用螢光顯微鏡可以對生物樣品發出的螢光進行觀察和分析,但是螢光顯微鏡收集到的是樣品的整體螢光,來自樣品內不同部位的螢光信號相互干擾。難以區分,無法獲得準確的定位和定量信息。 共聚焦顯微技術的出現很好地解決了這一問題,這一技術可以獲取細胞內某個薄層面上的螢光信息,而該層以外的信號被消除掉,成像清晰程度大大提高;結合計算機自動控制,可以對螢光信號的分布、強度和動態變化進行全方位的分析,得到豐富的信息。
與傳統
顯微鏡相比共聚焦顯微鏡可抑制圖像的模糊,獲得清晰的圖像;具有更高的軸向解析度,並可獲取連續光學切片;增加側向解析度;由於點對點掃描去除了雜散光的影響。
共聚焦顯微鏡原理
共聚焦顯微鏡利用放置在光源後的照明針孔和放置在檢測器前的探測針孔實現點照明和點探測,來自光源的光通過照明針孔發射出的光
聚焦在樣品焦平面的某個點上,該點所發射的螢光成像在探測針孔內,該點以外的任何發射光均被探測針孔阻擋。照明針孔與探測針孔對被照射點或被探測點來說是共軛的,因此被探測點即為共焦點,被探測點所在的平面即為共焦平面。計算機以像點的方式將被探測點顯示在計算機螢幕上,為了產生一幅完整的圖像,由光路中的掃描系統在樣品焦平面上掃描,從而產生一幅完整的共焦圖像。只要載物台沿著Z軸上下移動,將樣品新的一個層面移動到共焦平面上,樣品的新層面又成像在顯示器上,隨著Z軸的不斷移動,就可得到樣品不同層面的連續光切圖像。
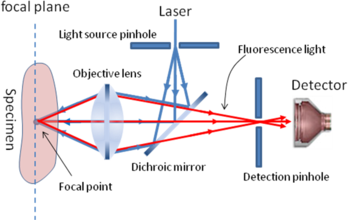 共聚焦原理
共聚焦原理共聚焦顯微鏡實現方式
目前共聚焦的實現有兩種方式:雷射共聚焦和數字共聚焦。
雷射掃描共聚焦
這種共聚焦技術利用雷射作為激發光源,將雷射聚焦於樣品中的某一點,這樣只有該點附近的區域有螢光,其他沒有被激發的部位沒有螢光,這一區域發出的螢光反射到光電倍增管,在光電倍增管前設有1 個計算機控制的可調節針孔, 保證只有被激發點發出的螢光才能到達
光電管,而附近其他點所發出的螢光被擋在視野之外。採用計算機控制雷射和針孔, 對細胞內的某一層面進行掃描,可以獲得清晰的二維圖像。
這一技術成像速度快、
自動化程度高。但雷射具有單色性,一種雷射器只能發出某幾個特定波長的雷射,而螢光染料的種類很多,其激發光波長各不相同,這樣在使用某種型號的雷射器時,只有少數幾種螢光染料可以使用, 而其他大多數的染料不能使用;目前同時配備數個不同雷射器或多光子脈衝雷射器的雷射
共聚焦系統的出現,雖然可以解決這一難題,但是設備結構複雜、價格昂貴,維護保養要求較高。
數字共聚焦
這一技術是隨著計算機軟體技術的發展出現的,與雷射共聚焦的原理有極大的區別, 它在普通的螢光顯微鏡上加上1 個計算機控制的高解析度、帶有製冷裝置(以提高
信噪比) 的CCD 攝像機, 攝像機獲取的圖像由計算機進行解卷積(deconvolution) 計算, 這種數字式圖像處理可以將聚焦平面以外的圖形信號刪除, 保留高清晰度的焦平面信息。
這一系統硬體配備比較簡單,價格遠遠低於雷射共聚焦系統;由於使用可以發出連續光譜的高壓汞燈或氙燈作為光源,使這一技術幾乎可以用於所有的螢光染料,套用範圍廣泛, 其機械部分組成簡單,靈活性高。這一技術的不足在於其圖像獲取、計算對計算機的依賴性高,圖象獲取時間相對較長,實驗時除要分析的層面被激發外,細胞內其他部位也被激發, 增加了螢光染料的光淬滅,對某些容易被光淬滅的染料會造成明顯的影響;隨著計算機和攝像技術的發展,這些問題也在逐步解決。
共聚焦顯微技術的相關技術
染色劑的選擇
隨著螢光分析技術的不斷發展,化學合成、分子生物學技術的進步, 不斷有新型的螢光染料被開發出來, 已經成功套用於生物學研究的染色劑可以用於對細胞膜、各種細胞器、細胞核、細胞骨架、細胞內游離離子(Ca
2+、M g
2+等) 和多糖等物質的染色。在實驗之前首先確定要研究的目標, 針對研究者使用的共聚焦顯微鏡的類型正確選擇所用染料的種類和形式。研究目的和材料不同, 選用的染色劑也各不相同, 除有關文獻外, 有些螢光染色劑使用手冊集中介紹了各種染色劑的
化學結構、理化性質、用途、套用範圍和具體使用方法, 在選擇染色劑時可以作為參考。
染色技術
生物體內除了少數物質可以受激產生自發螢光之外, 大多數分子本身沒有螢光, 必須藉助於
染色技術。常用的染色方法有以下幾種。
孵育法
將樣品浸泡於染色劑溶液中, 染料分子通過擴散作用進入細胞內, 與樣品中的目的分子結合。這是套用比較多、也是最簡單的方法, 在套用於經過固定處理的細胞結構染色時效果不錯; 但是在活細胞染色時有時會因為細胞膜對染料的透性不夠或染料分子太大而無法進入細胞內影響染色效果。
損傷導入法
這是套用難以自由透過細胞膜的大分子染料時常用的一類方法, 主要有顯微注射法、電刺激穿孔導入法等, 利用各種手段在細胞膜上造成空洞以使染料進入細胞內。這類方法的主要優點是導入的成功率高、染料在細胞內的濃度有保證; 缺點是操作複雜繁瑣、掌握起來有一定的難度, 不適合大量細胞的測定, 而且損傷處理可能會對細胞的生理活動造成影響。
隨著生物學的發展, 發現了一些生物體記憶體在著可以受光刺激產生螢光的蛋白質——發光蛋白, 如水母發光蛋白(能與細胞內游離鈣離子結合)、綠色螢光蛋白等, 這些蛋白的基因已經被克隆出來用於製造轉基因生物。除了可以直接將某些螢光蛋白的基因導入細胞表達外, 還可以把我們要研究的某些蛋白質的基因與這些螢光蛋白質的基因整合到一起, 使之一起表達合成並連線在一起, 共同存在於細胞內。對這些與目的蛋白結合在一起的螢光蛋白的螢光位置及強度進行分析, 可以獲得目的蛋白在細胞內定位、在發育過程中表達合成的動態變化情況。目前可以用於顯微注射的螢光蛋白、螢光蛋白基因、經過改造可供連線用的螢光蛋白基因片段乃至連線了螢光蛋白基因的某些目的蛋白基因都有商品出售, 大大方便了研究工作的開展。
圖像及數據處理
樣品經共聚焦顯微鏡觀察得到圖像及數據後, 圖像和數據的加工處理是一項關鍵技術, 也是耗時費力的一步, 各個共聚焦顯微鏡生產廠家一般都有配套的圖像加工和數據處理軟體, 用法各不相同。除這些軟體外, 一些通用的圖像加工和數據處理軟體也是數據及圖形加工處理過程中經常用到的。
共聚焦顯微技術的優點
成像清晰
由於利用光學或數位技術消除了聚焦平面以外的螢光信號的干擾, 使我們要分析的區域內的圖像
清晰度提高, 得到更為準確的定位和定量信息。
連續片層掃描及圖像重組
共聚焦顯微鏡在計算機的控制下可以對樣品中的不同層面進行連續逐層掃描, 以獲得各個層面的圖像, 層面之間的間距可以達到0. 1微米甚至更小, 在圖像獲得後由計算機自動將這些圖形重組為三維圖像。與普通光學照相機獲得的圖像比較,共聚焦所得到的重組三維立體圖形清晰度高、層次分明、立體感更強, 通過計算機軟體處理, 可以對三維圖形進行任何形式的旋轉, 可以從任何角度進行觀察, 還可以對細胞內的某個選定結構進行長度、體積的測量和計算, 在分析細胞內的空間結構和某些物質在細胞內的精確定位方面具有明顯的優勢, 這也是共聚焦顯微技術諸多功能中套用最廣泛的一種。
多標記技術
利用共聚焦系統可以同時對利用兩種或三種不同的螢光染料分別標記了細胞的不同結構(如分別標記染色體和細胞骨架系統) 的樣品進行觀察, 這樣一次實驗觀察就可以獲得細胞內不同結構的信息, 對不同結構組分的定位、相互聯繫方式進行研究。在最終獲得的圖像可以分開表示單個結構; 也可以將圖片迭加在一起, 用不同顏色表示不同的結構, 更加直觀, 這是普通螢光顯微鏡無法做到的。
活體觀察
除了可以對固定標本的細胞進行觀察外, 共聚焦顯微技術還可以在不對細胞進行固定或其他損傷性處理的情況下進行觀察, 獲得活細胞內的信息, 顯示在活體情況下細胞內的真實結構和生理學特徵。更為重要的是利用共聚焦顯微鏡可以跟蹤自然狀態下或受某種因素刺激後活細胞內的結構和生理過程隨時間變化的情況, 得到準確而直觀的動態變化資料, 為分析細胞內的生理
生化反應提供直接的實驗數據。
獲得數量化信息
共聚焦顯微技術不僅能夠對細胞內螢光進行定位, 還可以對其進行定量分析, 獲得二維或三維空間內分布在樣品不同部位的螢光強度數值以及螢光強度在各種處理條件下的變化情況。量化信息的獲得是研究活細胞內生理生化反應時重要的手段, 而共聚焦顯微技術在這一方面的優勢是其他技術所無法達到的。
共聚焦顯微技術的套用
共聚焦顯微技術的套用範圍包括形態學觀察與測量、生物學測量蛋白質功能檢測與包括在
光譜測量中的其它方面的套用。
其中該技術在形態學的觀察與測量方面包括亞細胞器定位,如最簡單的二維定位、定量及三維定位、圖像重組等。
生物學測量方面可以分為動態與靜態的生物學測量,在動態與靜態水平都可以同時檢測活細胞或組織內游離Ca2+分布和濃度的變化(Mg2+ 、Na+ 、K+等)、自由基的動靜態水平、線粒體膜電位的動靜態變化及蛋白質的轉位(不過靜態測量時需用固定樣品)。此外,動態測量還可以對藥物進入細胞的動態過程進行定位分布及定量。
蛋白質功能檢測可分為蛋白螢光恢復的測量(FRAP)與FLIP、籠索解籠索的測量與動態/靜態兼可的螢光能量共振轉移(FRET)三種測量方式。
 共聚焦原理
共聚焦原理