基本介紹
- 中文名:免疫膠體金技術
- 外文名:Immune colloidal gold technique
- 英文縮寫:GICT
- 作用:一種新型的免疫標記技術
簡介,使用優點,顆粒製備,蛋白製備,組成結構,測試原理,套用,
簡介
免疫膠體金技術(Immune colloidal gold technique) 是以膠體金作為示蹤標誌物套用於抗原抗體的一種新型的免疫標記技術,英文縮寫為:GICT。膠體金是由氯金酸(HAuCl4)在還原劑如白磷、抗壞血酸、枸櫞酸鈉、鞣酸等作用下,聚合成為特定大小的金顆粒,並由於靜電作用成為一種穩定的膠體狀態,稱為膠體金。膠體金在弱鹼環境下帶負電荷,可與蛋白質分子的正電荷基團形成牢固的結合,由於這種結合是靜電結合,所以不影響蛋白質的生物特性。 膠體金除了與蛋白質結合以外,還可以與許多其它生物大分子結合,如SPA、PHA、ConA等。根據膠體金的一些物理性狀,如高電子密度、顆粒大小、形狀及顏色反應,加上結合物的免疫和生物學特性,因而使膠體金廣泛地套用於免疫學、組織學、病理學和細胞生物學等領域。
使用優點
(1)使用方便快速,便於基層使用和現場使用,所有反應能在15分鐘內完成;
(2)成本低,不需要特殊的儀器設備;
(3)套用範圍廣,可適應多種檢測條件;
(4)可以進行多項檢測,若陽性樣本比較難獲得,多項檢測可以節省樣品,降低成本;
(5)標記物穩定,標記樣品在4℃貯存兩年年以上,無信號衰減現象;
(6)膠體金本身為紅色,不需要加入發色試劑,省卻了酶標的致癌性底物及終止液的步驟,對人體無毒害。
顆粒製備
根據不同的還原劑可以製備大小不同的膠體金顆粒。常用來製備膠體金顆粒的方法如下。
1.枸櫞酸三鈉還原法
(1)10nm膠體金粒的製備:取0.01%HAuCl4水溶液100ml,加入1%枸櫞酸三鈉水溶液3ml,加熱煮沸30min,冷卻至4℃,溶液呈紅色。
(2)15nm膠體金顆粒的製備:取0.01%HAuCl4水溶液100ml,加入1%枸櫞酸三鈉水溶液2ml,加熱煮沸15min~30min,直至顏色變紅。冷卻後加入0.1Mol/L K2CO30.5ml,混勻即可。
(3)15nm、18nm~20nm、30nm或50nm膠體金顆粒的製備:取0.01%HAuCl4水溶液100ml,加熱煮沸。根據需要迅速加入1%枸櫞酸三鈉水溶液4ml、2.5ml、1ml或0.75ml,繼續煮沸約5min,出現橙紅色。這樣製成的膠體金顆粒則分別為15nm、18~20nm、30nm和50nm。
2.鞣酸—枸櫞酸鈉還原法
A液:1%HAuCl4水溶液1ml加入79ml雙餾水中混勻。
B液:1%枸櫞酸三鈉4ml,1%鞣酸0.7ml,0.1Mol/L K2CO3液0.2ml,混合,加入雙餾水至20ml。
將A液、B液分別加熱至60℃,在電磁攪拌下迅速將B液加入A液中,溶液變藍,繼續加熱攪拌至溶液變成亮紅色。此法製得的金顆粒的直徑為5nm。
3.製備高質量膠體金的注意事項
(1)玻璃器皿必須徹底清洗,最好是經過矽化處理的玻璃器皿,或用第一次配製的膠體金穩定的玻璃器皿,再用雙餾水沖洗後使用。否則影響生物大分子與金顆粒結合和活化後金顆粒的穩定性,不能獲得預期大小的金顆粒。
(3)配製膠體金溶液的pH以中性(pH7.2)較好。
(4)氯金酸的質量要求上乘,雜質少。最好是進口的。
(5)氯金酸配成1%水溶液在4℃可保持數月穩定,由於氯金酸易潮解,因此在配製時,最好將整個小包裝一次性溶解。
蛋白製備
膠體金對蛋白的吸附主要取決於pH值,在接近蛋白質的等電點或偏鹼的條件下,二者容易形成牢固的結合物。如果膠體金的pH值低於蛋白質的等電點時,則會聚集而失去結合能力。除此以外膠體金顆粒的大小、離子強度、蛋白質的分子量等都影響膠體金與蛋白質的結合。
1.待標記蛋白溶液的製備 將待標記蛋白預先對0.005Mol/L pH7.0 NaCl溶液中4℃透析過夜,以除去多餘的鹽離子,然後100 000g4℃離心1h,去除聚合物。
2.待標膠體金溶液的準備 以0.1Mol/L K2CO3或0.1Mol/L HCl調膠體金液的pH值。標記IgG時,調至9.0;標記McAb時,調至8.2;標記親和層析抗體時,調至7.6;標記SPA時,調至5.9~6.2;標記ConA時,調至8.0;標記親和素時,調至9~10。
由於膠體金溶液可能損壞pH計的電板,因此,在調節pH時,採用精密pH試紙測定為宜。
3.膠體金與標記蛋白用量之比的確定
(1)根據待標記蛋白的要求,將膠體金調好pH之後,分裝10管,每管1ml。
(3)5min後,在上述各管中加入0.1ml 10%NaCl溶液,混勻後靜置2h,觀察結果。
(4)結果觀察,對照管(未加蛋白質)和加入蛋白質的量不足以穩定膠體金的各管,均呈現出由紅變藍的聚沉現象;而加入蛋白量達到或超過最低穩定量的各管仍保持紅色不變。以穩定1ml膠體金溶液紅色不變的最低蛋白質用量,即為該標記蛋白質的最低用量,在實際工作中,可適當增加10%~20%。
4.膠體金與蛋白質(IgG)的結合 將膠體金和IgG溶液分別以0.1Mol/L K2CO3調pH至9.0,電磁攪拌IgG溶液,加入膠體金溶液,繼續攪拌10min,加入一定量的穩定劑以防止抗體蛋白與膠體金聚合發生沉澱。常用穩定劑是5%胎牛血清(BSA)和1%聚乙二醇(分子量20KD)。加入的量:5%BSA使溶液終濃度為1%;1%聚乙二醇加至總溶液的1/10。
5.膠體金標記蛋白的純化
為了得到顆粒均一的免疫金試劑,可將上述初步純化的結合物再進一步用10%~30%蔗糖或甘油進行密度梯度離心,分帶收集不同梯度的膠體金與蛋白的結合物。
(2)凝膠過濾法:此法只適用於以BSA作穩定劑的膠體金蛋白結合物的純化。將膠體金蛋白結合物裝入透析袋,在矽膠中脫水濃縮至原體積的1/5~1/10。再經1 500r/min離心20min。取上清加至Sephacryl S-400(丙烯葡聚糖凝膠S-400)層析柱分別純化。層析柱為0.8 cm×20cm,加樣量為床體積的1/10,以0.02Mol/L PBS液洗脫(內含0.1%BSA,0.05%NaN3,pH8.2者用IgG標記物),流速為8ml/h。按紅色深淺分管收集洗脫液。一般先濾出的液體為微黃色,有時略混濁,內含大顆粒聚合物等雜質。繼之為純化的膠體金蛋白結合物,隨濃度的增加而紅色逐漸加深,清亮透明,最後洗脫出略帶黃色的為標記的蛋白組分。將純化的膠體金蛋白結合物過濾除菌、分裝,4℃保存。最終可得到70%~80%的產量。
6.膠體金蛋白結合物的質量鑑定
(1)膠體金顆粒平均直徑的測量:用支持膜的鎳網(銅網也可)蘸取金標蛋白試劑,自然乾燥後直接在透射電鏡下觀察。或用醋酸鈾復染後觀察。計算100個金顆粒的平均直徑。
(2)膠體金溶液的OD520nm值測定:膠體金顆粒在波長510nm~550nm之間出現最大吸收值峰。用0.02Mol/L pH8.2 PBS液(含1%BSA,0.02%NaN3)將膠體金蛋白試劑作1︰20稀釋,OD520=0.25左右。一般套用液的OD520應為0.2~0.4。
(3)金標記蛋白的特異性與敏感性測定:採用微孔濾膜免疫金銀染色法(MF-IGSSA)。將可溶性抗原(或抗體)吸附於載體上(濾紙、硝酸纖維膜、微孔濾膜),用膠體金標記的抗體(或抗原)以直接或間接染色法並經銀顯影來檢測相應的抗原或抗體,對金標記蛋白的特異性和敏感性進行鑑定。
組成結構
膠體金作為免疫標記物始於1971年,由Faulk和Taylor將其引入免疫化學。Faulk 和Taylor首先將兔抗沙門氏菌抗血清與膠體金顆粒結合,用直接免疫細胞化學技術檢測沙門氏菌的表面抗原。此後,他們還把膠體金與抗膠原血清,植物血凝素,卵白蛋白,人免疫球蛋白輕鏈、牛血清白蛋白結合套用。1974年Romano和他的同事們將膠體金標記在馬抗人的IgG上,實現了間接免疫金染色法。層析法檢測試劑最早出現於1988年,是Unipath公司利用染料顆粒開發生產的一種非常方便使用的懷孕檢測試劑。1989年,Spielberg F等發展了以膠體金為標記物用於檢測愛滋病毒抗體的滲濾法檢測試劑,此後,免疫膠體金在快速檢測試劑中得到了廣泛的套用和發展,相伴隨的層析法檢測試劑在組成結構、生產用的材料等方面也取得了長足的進步。
目前市場上見到的典型的層析法檢測試劑的組成成份可分為三個部分,其一是多孔材料,包括樣品墊、吸水墊、結合墊及硝酸纖維膜;其二是試劑,如抗體、金標結合物等;其三是層壓結構及卡盒,如PVC板、雙面膠、盒等(見表1及圖1)。
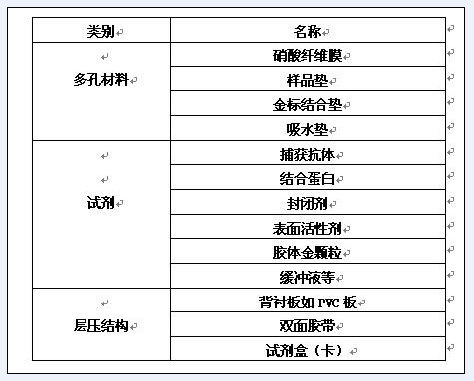 表1 層析法免疫膠體金檢測試劑的組成成分
表1 層析法免疫膠體金檢測試劑的組成成分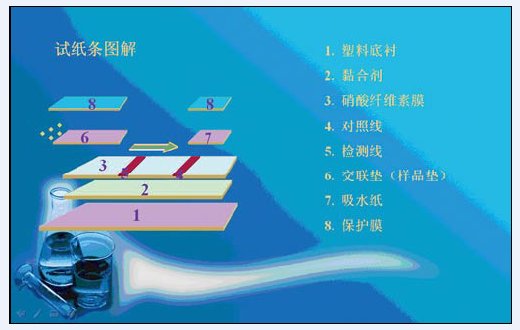 圖1 層析法免疫膠體金檢測試劑結構示意圖
圖1 層析法免疫膠體金檢測試劑結構示意圖層析法檢測試劑的各組分,並非簡單的相互疊加,改變其中的任一組分,都可能引起產品整體性能的變化。以最常見的早早孕檢測試劑為例,影響其產品敏感度的因素可能有:
*硝酸纖維膜的特性,主要反應在其流速上。
*膠體金顆粒的大小,濃度等
*結合墊的性能,金標結合物的量
*樣品墊的特性
*檢測線的位置及寬度
*硝酸纖維膜和結合墊的疊壓強度
*捕獲抗體的親合力
*檢測線包被捕獲抗體的量
*結合抗體的特性
測試原理
*方便使用,體現在操作簡單,不需經過特殊培訓。
*短時間獲得檢測結果,一般10-15分鐘即可得出結論。
*不同環境下的穩定性好,不需冷藏。
*相比而言,其生產成本和檢測成本均較低。
*檢測標本種類多:可用於查血、尿液或糞便,因而適合各種檢查
套用
膠體金標記技術由於標記物的製備簡便,方法敏感、特異,不需要使用放射性同位素,或有潛在致癌物質的酶顯色底物,也不要螢光顯微鏡,它的套用範圍廣,除套用於光鏡或電鏡的免疫組化法外,更廣泛地套用於各種液相免疫測定和固相免疫分析以及流式細胞術等。
1.液相免疫測定:將膠體金與抗體結合,建立微量凝集試驗檢測相應的抗原,如間接血凝一樣,用肉眼可直接觀察到凝集顆粒。利用免疫學反應時金顆粒凝聚導致顏色減退的原理,建立均相溶膠顆粒免疫測定法(Sol particle immunoassay ,SPIA)已成功地套用於PCG的檢測,直接套用分光光度計進行定量分析。
2.金標記流式細胞術:膠體金可以明顯改變紅色雷射的散射角,利用膠體金標記的羊抗鼠Ig抗體套用於流式細胞術,分析不同類型細胞的表面抗原,結果膠體金標記的細胞在波長632nm時,90度散射角可放大10倍以上,同時不影響細胞活性。而且與螢光素共同標記,彼此互不干擾。
3.膠體金固相免疫測定法