方程具體形式
理想氣體狀態方程
,描述理想
氣體狀態變化規律的方程。由克拉伯龍於將
玻意耳定律和
蓋-呂薩克定律合併起來。特此澄清一點,部分國內教材將理想氣體狀態方程和克拉伯龍方程畫等號,這是不正確的。儘管理想氣體狀態方程是由克拉伯龍提出的,但是克拉伯龍方程所描述的是相平衡的物理量。國際慣例,將理想氣體狀態方程稱為State Equation of Ideal Gas 或者 Ideal Gas law, 而克拉伯龍方程 Clapeyron Equation的同義詞是 Clausius-Clapeyron Relation 或者 Clapeyron Equation.大量百度知道和之前的中文百科混淆了這一點。
式中M和n分別是理想氣體的摩爾質量和
物質的量;R是
氣體常量。p為理想氣體壓強,單位Pa。V為氣體體積,單位m3。n為氣體的物質的量,單位mol,T為體系溫度,單位K。對於混合理想氣體,其
壓強p是各組成部分的分壓強p1、 p2、……之和,故:( p1+ p2+……)V=(n1+n2+……)RT,式中n1、n2、……是各組成部分的物質的量。
以上兩式是理想氣體和混合理想氣體的狀態方程,可由理想氣體嚴格遵循的
氣體定律得出,也可根據理想氣體的微觀模型,由
氣體動理論導出。在
壓強為幾個大氣壓以下時,各種實際氣體近似遵循理想氣體狀態方程,壓強越低,符合越好,在壓強趨於零的極限下,嚴格遵循。
R為比例係數,不同狀況下數值有所不同,單位是J/(mol·K)。
在摩爾表示的狀態方程中,R為比例
常數,對任意理想氣體而言,R是一定的,約為8.31441±0.00026J/(mol·K)。
如果採用質量表示狀態方程,pV=mrT,此時r是和氣體種類有關係的,r=R/M,M為此氣體的平均摩爾質量。
用密度表示該關係:pM=ρRT(M為摩爾質量,ρ為密度)。
理想氣體狀態方程是由研究低壓下氣體的行為導出的。但各氣體在適用理想
氣體狀態方程時多少有些偏差;壓力越低,偏差越小,在極低壓力下
理想氣體狀態方程可較準確地描述氣體的行為。極低的壓強意味著分子之間的距離非常大,此時分子之間的相互作用非常小;又意味著分子本身所占的體積與此時氣體所具有的非常大的體積相比可忽略不計,因而分子可近似被看作是沒有體積的質點。於是從極低壓力氣體的行為觸發,抽象提出理想氣體的概念。
理想氣體在微觀上具有分子之間無互相作用力和分子本身不占有體積的特徵。
滿足方程的氣體
滿足理想氣體狀態方程且比熱比為常數的氣體,稱為完全氣體,從微觀角度來看,它是分子本身體積與分子間作用力都可以忽略不計的氣體。在常溫常壓下,實際氣體分子的體積和分子間的相互作用也可忽略不計,狀態參數基本能夠滿足理想氣體狀態方程,所以空氣動力學常把實際氣體簡化為完全氣體來處理。在低速空氣動力學中,空氣就可以被視為比熱比為常數的完全氣體;在高速空氣動力學中,氣流的溫度較高,空氣中氣體分子的轉動能和振動能隨著溫度的升高而相繼受到激發,比熱比不再是常數,在1500~2000K的溫度範圍內,空氣可視為變比熱比的完全氣體。
相關定律
推導經驗定律
(1)
玻義耳定律(玻—馬定律)(Boyles‘s Law)
當n,T一定時 V,p成反比,即V∝(1/p)①
當p,n一定時 V,T成正比,即V∝T ②
當n,V一定時 T,p成正比,即p∝T ③
當T,p一定時 V,n成正比,即V∝n ④
由①②③④得
V∝(nT/p) ⑤
將⑤加上比例係數R得
V=(nRT)/p 即pV=nRT
實際氣體中的問題當理想氣體狀態方程運用於實際氣體時會有所偏差,因為理想氣體的基本假設在實際氣體中並不成立。如實驗測定1 mol
乙炔在20℃、101kPa時,體積為24.1 dm3,,而同樣在20℃時,在842 kPa下,體積為0.114 dm3,,它們相差很多,這是因為,它不是理想氣體所致。
一般來說,
沸點低的氣體在較高的溫度和較低的壓力時,更接近理想氣體,如
氧氣的沸點為-183℃、
氫氣沸點為-253℃,它們在常溫常壓下
摩爾體積與理想值僅相差0.1%左右,而
二氧化硫的沸點為-10℃,在常溫常壓下
摩爾體積與理想值的相差達到了2.4%。
套用一定量處於平衡態的
氣體,其狀態由
p、V和
T刻劃,表達這幾個量之間的關係的方程稱之為氣體的狀態方程,不同的氣體有不同的狀態方程。但
真實氣體的方程通常十分複雜,而理想氣體的狀態方程具有非常簡單的形式。
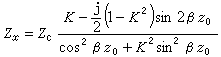 理想氣體狀態方程
理想氣體狀態方程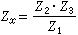 理想氣體狀態方程
理想氣體狀態方程雖然完全理想的氣體並不可能存在,但許多實際氣體,特別是那些不容易
液化、
凝華的氣體(如
氦、
氫氣、
氧氣、
氮氣等,由於
氦氣不但體積小、互相之間作用力小、也是所有氣體中最難液化的,因此它是所有氣體中最接近
理想氣體的氣體。)在常溫常壓下的性質已經十分接近於理想氣體。
此外,有時只需要粗略估算一些數據,使用這個方程會使計算變得方便很多。
研究過程
這個方程是兩個多世紀以來許多科學家經過不斷地試驗、觀察、歸納總結才取得的成果,匯集了許多由2個變數的實驗定律而構成。
玻意耳-馬略特定律
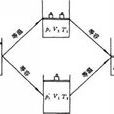
1662年,英國化學家
波義耳使用類似右圖的U型玻璃管進行實驗:用
水銀壓縮被密封於玻璃管內的空氣。加入水銀量的不同會使其中空氣所受的壓力也不同。波義耳經過觀察管內空氣的體積隨水銀柱高度不同而發生的變化,記錄了如下一組數據(一定量空氣在室溫、大氣壓為29.1 in
Hg下):
l(刻度讀數)
| 40
| 38
| 36
| 34
| 32
| 30
|
|---|
Δh/(in Hg)
| 6.2
| 7.9
| 10.2
| 12.5
| 15.1
| 18.0
|
|---|
經過觀察,他認為在管粗細均勻的情況下,管中空氣的體積與空氣柱 l 成正比,而空氣所受壓力為大氣壓與水銀柱壓差Δh的和;據此,他認為在恆溫下,一定量的空氣所受的壓力與氣體的體積成反比。
其他兩位科學家,貝蒂和布里茲曼也研究了氫氣的體積和壓力的關係,下面是他們的實驗數據:
多種氣體的試驗均得到了相同的結果,這個結果總結為玻意耳-馬略特定律,即:溫度恆定時,一定量氣體的壓力和它的體積的乘積為恆量。
查理定律
1787年,
查理研究
氧氣、
氮氣、
氫氣、
二氧化碳及
空氣等氣體從0℃加熱到100℃時的膨脹情況,發現在壓力不太大時,任何氣體的膨脹速率是一樣的,而且是
攝氏溫度的
線性函式。即某一氣體在100℃中的體積為,而在0℃時為,經過實驗,表明任意氣體由0℃升高到100℃,體積增加37%。
蓋-呂薩克定律
1802年,
蓋-呂薩克在試驗中發現,體積不變時,一定量的氣體的壓力和溫度成正比,即溫度每升高(或降低)1℃,其壓力也隨之增加(或減少)其0℃時壓力的。
查理-蓋呂薩克定律
主條目:查理-蓋呂薩克定律
綜合
19世紀中葉,法國科學家
克拉珀龍綜合
波義耳定律和查理-蓋呂薩克定律,把描述氣體狀態的3個參數:
p、
V、
T歸於一個方程,表述為:
一定量氣體,體積和壓力的乘積與熱力學溫度成正比。 推廣
經過Horstmam和
門捷列夫等人的支持和提倡,19世紀末,人們開始普遍地使用現行的理想氣體狀態方程:pV=nRT。
套用
計算氣體所含物質的量
從數學上說,當一個方程中只含有1個未知量時,就可以計算出這個未知量。因此,在
壓強、體積、溫度和所含物質的量這4個量中,只要知道其中的3個量即可算出第四個量。這個方程根據需要計算的目標不同,可以轉換為下面4個等效的公式:
求壓強: p=nRT/v
求體積: v=nRT/p
求所含物質的量:n=pv/RT
求溫度:T=pv/nR
計算化學平衡問題
根據理想氣體狀態方程可以用於計算氣體反應的化學
平衡問題。
根據理想氣體狀態方程可以得到如下推論:
溫度、
體積恆定時,氣體壓強之比與所含物質的量的比相同,即可得Ρ平/P始=n平/n始
溫度、
壓強恆定時,氣體體積比與氣體所含物質的量的比相同,即V平/V始=n平/n始
通過結合化學反應的方程,很容易得到化學反應達到平衡狀態後制定物質的轉化率。
實際氣體狀態方程
實際氣體都不同程度地偏離理想氣體定律。偏離大小取決於壓力、溫度與氣體的性質,特別是取決於氣體液化的難易程度。對於處在室溫及1大氣壓左右的氣體,這種偏離是很小的,最多不過百分之幾。如氧氣和氫氣是沸點很低的氣體(-183攝氏度和-253攝氏度),在25攝氏度和1大氣壓時,摩爾體積與理想值的偏差在0.1%以內。而沸點較高的二氧化硫和氯氣(-10攝氏度與-35攝氏度),在25攝氏度與1大氣壓下就不很理想。它們的摩爾體積比按理想氣體定律預計的數值分別低了24%與16%。當溫度較低、壓力較高時,各種氣體的行為都將不同程度地偏離理想氣體的行為。此時需要考慮分子間的引力和分子本身的體積重新構造氣體狀態方程。
注釋
p為理想氣體的壓強,單位通常為atm或kPa;
V為理想氣體的體積,單位為L或稱dm3;
n為理想氣體中氣體物質的量,單位為mol;
T為理想氣體的絕對溫度,單位為K
^ 在所有氣體當中,氦氣是構成粒子中最小的,氫氣僅次之。
^ 氦還是唯一不能在標準大氣壓下固化的物質。
^ 約合739mm
^ atm為標準大氣壓,1atm=101.3 kPa
^ 當時
查理認為是膨脹1/267,1847年法國化學家雷諾將其修正為1/273.15。
^ 其實查理早就發現壓力與溫度的關係,只是當時未發表,也未被人注意。直到蓋-呂薩克重新提出後,才受到重視。早年都稱“
查理定律”,但為表彰蓋-呂薩克的貢獻而稱為“查理-蓋呂薩克定律”。
^ 如二氧化碳在40℃、52 MPa時,Z≈1.0
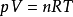



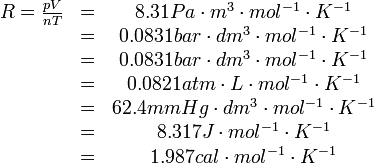
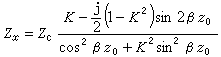 理想氣體狀態方程
理想氣體狀態方程 理想氣體狀態方程
理想氣體狀態方程