基本介紹
- 中文名:休克爾規則/4n+2規則/Hückel規則
- 外文名:Hückel's rule
- 別稱:有機化學的經驗規則
- 提出時間:1931年
- 人物:休克爾
- 相關性質:芳香性
簡介
規則作用
規則原理及證明
規則不足之處
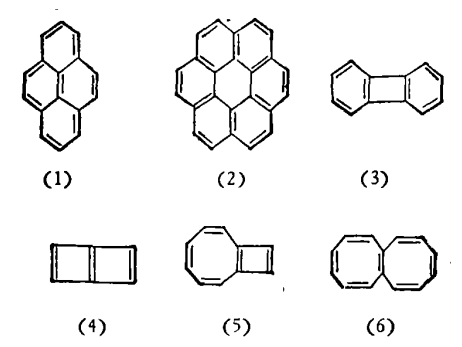 多環共軛體系
多環共軛體系
 多環共軛體系
多環共軛體系Hückel規則(休克爾規則)是有機化學的經驗規則,它指當閉合環狀平面型的共軛多烯(輪烯)π電子數為(4n+2)時(其中n為0或者正整數),具有芳香性。從凱庫勒(Kekule)...
休克爾(Erich Armand Arthur Joseph Hückel,1896年8月9日-1980年2月16日),男,聯邦德國物理學家和物理化學家。...
薁又稱為藍烴,分子式為C10H8,可以看成是由環戊二烯負離子和環庚三烯正離子稠合而成的。具有環狀平面共軛體系,π電子數為10 ,符合4n+2 (n=2)休克爾規則...
同芳香性是指共平面,π電子數為4n+2,共面的原子均為sp2或sp雜化的輪烯上,帶有不與輪烯共平面的取代基或橋。判斷芳香性重要的規則是休克爾規則。...
環丁二烯,苯,環辛四烯和環十八碳九烯分別稱[4]輪烯,[6]輪烯,[8]輪烯和[18]輪烯.它們是否具有芳香性,可按休克爾規則判斷,首先看環上的碳原子是否均處於一...
Hückel規則(休克爾規則)是有機化學的經驗規則,它指當閉合環狀平面型的共軛多烯(輪烯)π電子數為(4n+2)時,具有芳香性。從凱庫勒(kkul)提出苯的環狀結構,並...
環丁二烯是最簡單的[n]-輪烯([4]-輪烯),化學式為C4H4。它是一種極不穩定的碳氫化合物,僅能單獨存在5秒鐘。儘管環丁二烯含有交替的單雙鍵,但是它不符合休克爾...
蒄具有芳香性,雖然其具有24個離域電子,不符合休克爾規則,但是休克爾規則只能在單環體系下被理論證明。由共振論蒄的芳香性可用20個共振式組成的共振雜化體解釋。 ...
穆斯堡爾譜學數據顯示,二茂鐵中心鐵原子的氧化態為+2,每個茂環帶有一個單位負電荷。因此每個環含有6個π電子,符合休克爾規則中4n+2電子數的要求(n為非負整數)...
其它的化合物可以根據休克爾規則來判斷是否具有芳香性。具體表述是對完全共軛的、單環的、平面多雙鍵物質來說,具有(4n+2)個離域π電子(這裡n是大於或等於零的...
安托萬·拉瓦錫出版了《化學命名法》,這是第一部現代化學命名規則。...埃里希·休克爾提出了休克爾規則,這個經驗規則可以推斷平面環狀分子是否具有芳香...
·休克爾通過分子軌道計算得出了環烯烴芳香性判定的休克爾規則(亦名4n+2規則),其它常見的非苯芳烴包括薁、[18]輪烯等;而石墨的每一層都有一個無窮大的π鍵,...
[18]輪烯(或[18]-輪烯,IUPAC命名檔案)即“環十八碳九烯”,是大環輪烯家族的一員,分子式C18H18,因符合休克爾規則(即4n+2規則)而有芳香性。由於環足夠大,...
由於其分子中氧原子的一對孤對電子在共軛軌道平面內形成大π鍵,使得共軛平面內共6個電子,符合4n+2結構,所以呋喃具有芳香性(見休克爾規則)。芳香性使得呋喃具有“...
對於凱庫勒烯的芳香性,化學家曾提出兩種凱庫勒烯的電子結構理論,一種為外環30π電子,內環18π電子,均符合休克爾規則,形成兩個離域大π鍵;另一種為菲的單元組成...
芳香雜環是具有平種結構特點的雜環,其環中原子構成一個環閉的共扼體系,分子呈平面型,此平面上下兩側有環狀的離域電子云,共扼體系中的P電子數都符合休克爾規則。...
由於不是平面結構,因此環辛四烯既沒有芳香性,也沒有反芳香性,也不適用於休克爾規則分析。如果將環辛四烯浴盆狀構象(D2d)的能量看作0,那么理論計算得出其雙鍵...
